
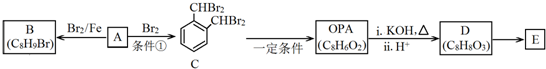
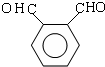
 .
.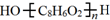 .D→E的化学方程式是n
.D→E的化学方程式是n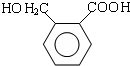 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$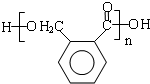 +(n-1)H2O(不必注反应条件).
+(n-1)H2O(不必注反应条件).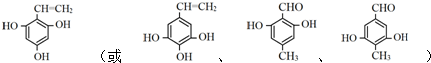 (写1种即可).
(写1种即可). 分析 A是摩尔质量为106g/mol的烃,根据商余法可知其分子式为C8H10,结合C的结构简式可知,A为 ,根据B的分子式可知,A与溴在铁作催化剂的条件下发生取代生成B为
,根据B的分子式可知,A与溴在铁作催化剂的条件下发生取代生成B为 ,根据OPA的分子式可知,OPA分子中含有2个相同的官能团,A发生取代反应生成C,C发生碱性水解得OPA为
,根据OPA的分子式可知,OPA分子中含有2个相同的官能团,A发生取代反应生成C,C发生碱性水解得OPA为 ,D中含2个不同的官能团,OPA发生Cannizzaro反应得D为
,D中含2个不同的官能团,OPA发生Cannizzaro反应得D为 ,D发生缩聚反应得E为
,D发生缩聚反应得E为 ,据此答题.
,据此答题.
解答 解:A是摩尔质量为106g/mol的烃,根据商余法可知其分子式为C8H10,结合C的结构简式可知,A为 ,根据B的分子式可知,A与溴在铁作催化剂的条件下发生取代生成B为
,根据B的分子式可知,A与溴在铁作催化剂的条件下发生取代生成B为 ,根据OPA的分子式可知,OPA分子中含有2个相同的官能团,A发生取代反应生成C,C发生碱性水解得OPA为
,根据OPA的分子式可知,OPA分子中含有2个相同的官能团,A发生取代反应生成C,C发生碱性水解得OPA为 ,D中含2个不同的官能团,OPA发生Cannizzaro反应得D为
,D中含2个不同的官能团,OPA发生Cannizzaro反应得D为 ,D发生缩聚反应得E为
,D发生缩聚反应得E为 ,
,
(1)根据上面的分析可知,A为 ,则A的分子式是 C8H10,
,则A的分子式是 C8H10,
故答案为:C8H10;
(2)根据上面的分析可知,A→B和A→C的反应类型都属于取代反应;其中“条件①”是 光照,
故答案为:取代;光照;
(3)根据上面的分析可知,则OPA的结构简式是  ,
,
故答案为: ;
;
(4)根据上面的分析可知,D→E的化学方程式是:n $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +(n-1)H2O,
+(n-1)H2O,
故答案为:n $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$ +(n-1)H2O;
+(n-1)H2O;
(5)D为 ,F是D的同分异构体,其苯环上的一氯代物只有1种,除苯环外不含其他环状结构,F的结构简式可能为
,F是D的同分异构体,其苯环上的一氯代物只有1种,除苯环外不含其他环状结构,F的结构简式可能为 ,
,
故答案为: .
.
点评 本题考查有机物的推断,明确有机物的官能团及其性质是解本题关键,难度中等,(5)中同分异构体的书写为易错点、难点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 加入的物质 | O2 | 氨水 |
| 沉淀的化学式 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| /min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A.0~2min的反应速率小于4~6min的反应速率 |
| B.2~6min用Cl2表示的反应速率为0.9mol/(L•min) |
| C.增大压强可以提高HCl转化率 |
| D.平衡常数K(200℃)<K(400℃) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na暴露于空气中最终生成Na2O2 | |
| B. | 铜粉能溶于酸性硝酸钠溶解 | |
| C. | Fe比Al更易与NaOH溶液反应生成H2 | |
| D. | 水蒸气通过灼热的铁粉会有红棕色固体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中 Mg2+、Al3+、SO42-、CO32- | |
| B. | pH=1的溶液中 NH4+、Ba2+、HCO3-、NO3- | |
| C. | 含MnO4-的溶液中 H+、K+、Br-、I- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中 Na+、K+、CH3COO-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com