解答:
解:(1)甲容器的体积为1L,加入6mol A和3mol B,则A、B的浓度分别为:6mol/L、3mol/L,4min时甲容器内的反应恰好达到平衡,A的浓度为2.4mol/L、B的浓度为1.8mol/L,则A、B的浓度变化为:△c(A)=6mol/L-2.4mol/L=3.6mol/L,B的浓度变化为:△c(B)=3mol/L-1.8mol/L=1.2mol/L,此时间内平均速率v(B)=
=0.3 mol?L
-1?min
-1;浓度变化与化学计量数成正比,则3:b=△c(A):△c(B)=3.6mol/L:1.2mol/L=3:1,则b=1,
故答案为:0.3 mol?L
-1?min
-1;1;
(2)甲容器的体积为1L,乙容器的体积为2L,乙容器的体积大于甲的,浓度小则反应速率小,到达平衡的时间长,所以乙容器中反应达到平衡时所需时间大于4min,
故答案为:大于; 乙容器的体积大于甲容器的体积,反应物浓度减小,反应速率减慢,达到平衡所需要的时间就要长;
(3)根据等效平衡规律,在恒温恒容下,转化为同一反应方向的物质的物质的量和原来对应相等即可,3molC、2molD完全转化后生成3molA和1molB,还需3molA和2molB才能与乙为等效平衡,
故答案为:3 mol;2 mol;
(4)由于该反应是体积增大的可逆反应,由于甲的容器体积小,则压强大,平衡向着逆向移动,甲中反应物的转化率小于乙,且达到平衡时甲中各组分浓度都大于乙的,
A.保持温度不变,增大甲容器的体积至2L,则此时甲和乙为等效平衡,甲、乙容器中B的平衡浓度相等,故A正确;
B.保持容器体积不变,使甲容器升高温度,该反应为放热反应,平衡向着逆向移动,甲中B浓度增大,则无法满足甲、乙容器中B的平衡浓度相等,故B错误;
C.保持容器压强和温度都不变,向甲中加入一定量的A气体,由于反应物A的浓度增大,则平衡向着正向移动,甲中B的浓度减小,可能实现甲、乙容器中B的平衡浓度相等,故C正确;
D.保持容器压强和温度都不变,向甲中加入一定量的B气体,达到平衡时甲中B的浓度更大,无法满足甲、乙容器中B的平衡浓度相等,故D错误;
故答案为:AC;
(5)反应3A(g)+bB(g)?3C(g)+2D(g)的平衡常数为:K=
;
T℃时甲容器中 3A(g)+B(g)?3C(g)+2D(g)
反应前(mol/L) 6 3 0 0
浓度变化(mol/L) 3.6 1.2 3.6 2.4
平衡时(mol/L) 2.4 1.8 3.6 2.4
在T℃时的化学平衡常数K=
=
=10.8,
故答案为:
;10.8.



 阅读快车系列答案
阅读快车系列答案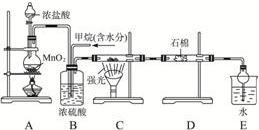
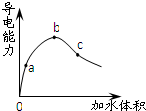 常温下,将一定量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.
常温下,将一定量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.