
【题目】已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2,该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是
A. 反应①的平衡常数K1=![]()
B. 反应③的平衡常数K=![]()
C. 对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值
D. 对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小
【答案】B
【解析】
A.固体、纯液体不计入平衡常数表达式;B、根据平衡常数的定义K1= ![]() 、K2=
、K2=![]() 、K=
、K=![]() ;C.若温度升高,H2的浓度减小,说明CO(g)+H2O(g)CO2(g)+H2(g)平衡逆向移动;D.固体不影响平衡移动。
;C.若温度升高,H2的浓度减小,说明CO(g)+H2O(g)CO2(g)+H2(g)平衡逆向移动;D.固体不影响平衡移动。
A. 固体、纯液体不计入平衡常数表达式,反应①的平衡常数K1= ![]() ,故A错误;B、根据平衡常数的定义K1=
,故A错误;B、根据平衡常数的定义K1= ![]() 、K2=
、K2=![]() 、K=
、K=![]() ,所以反应③的平衡常数K=
,所以反应③的平衡常数K= ![]() ,故B正确;C.若温度升高,H2的浓度减小,说明CO(g)+H2O(g)CO2(g)+H2(g)平衡逆向移动,所以该反应为放热反应,焓变为负值,故C错误;D. CuO是固体,固体不影响平衡移动,对于反应②,恒温恒容时,若加入CuO,平衡不移动,氢气浓度不变,故D错误。
,故B正确;C.若温度升高,H2的浓度减小,说明CO(g)+H2O(g)CO2(g)+H2(g)平衡逆向移动,所以该反应为放热反应,焓变为负值,故C错误;D. CuO是固体,固体不影响平衡移动,对于反应②,恒温恒容时,若加入CuO,平衡不移动,氢气浓度不变,故D错误。


 百年学典课时学练测系列答案
百年学典课时学练测系列答案科目:高中化学 来源: 题型:
【题目】工业上以氧化铝为原料可制得一些物质。
(1)碳热还原法可合成氮化铝(AlN)
已知:2Al2O3(s)==4Al(g)+3O2(g) △H1=+3351KJmol﹣1
2C(s)+O2(g)==2CO(g) △H2=-221KJmol﹣1
2Al(g)+N2(g)==2AlN(s) △H3=-318KJmol﹣1
碳热还原Al2O3合成AlN的总热化学方程式是________________________________________________,
(2)电解法可制取铝。以石墨作电极电解熔融 Al2O3(加入Na3AlF6为助熔剂)
①电解时铝在_____________产生(填阴极或阳极)
②电解过程中作阳极的石墨易消耗,原因是________________________。
(3)二氧化碳甲烷化再利用
①已知反应:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)写出该反应的平衡常数表达式________________________
CH4(g)+2H2O(g)写出该反应的平衡常数表达式________________________
②据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃组成的混合气体0.1mol, 完全燃烧得0.16molCO2和3.6g水。下列说法正确的是 ( )
A.混合气体一定没有甲烷B.混合气体中一定是甲烷和乙烯
C.混合气体中一定没有乙烷D.混合气体中一定有乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨及其相关工业中,部分物质间的转化关系如下:

下列说法不正确的是( )
A. 反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均属于氧化还原反应
B. 上述转化中包含了氨气、硝酸、硝铵、小苏打、纯碱的工业生产方法
C. 反应Ⅳ和Ⅵ中的部分产物可在上述流程中循环利用
D. 反应V是先向饱和氯化钠溶液中通CO2至饱和再通NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,D能与碳酸钠反应产生气体,F是一种高聚物,可制成多种包装材料。
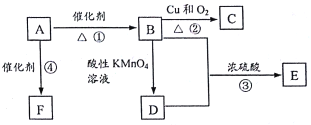
(1)A的结构式为___________。
(2)C分子中的官能团名称是_________,验证C物质存在该官能团的试剂是__________,现象为_________________________。
(3)写出下列反应的化学方程式并指出反应类型:
①____________________________:反应类型是______________;
③____________________________;反应类型是______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性。金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A. Cu与Cu2O的物质的量之比为2∶1 B. 硝酸的物质的量浓度为2.6mol/L
C. 产生的NO在标准状况下的体积为4.48L D. Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A. 用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
B. H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C. 将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D. H3PO2溶于水的电离方程式为H3PO2![]() H++ H2PO2-
H++ H2PO2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。
4CO(g)+2NO2(g)![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 (填代号)。
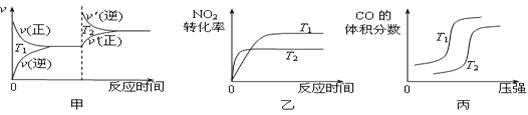
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g) ![]() N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(CO
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH= -l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式 。
(4)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。
电池反应为:4NH3+3O2=2N2+6H2O;
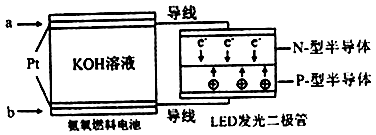
请写出通入a气体一极的电极反应式为 ;每消耗3.4g NH3转移电子的物质的量为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.5L盐酸和硫酸的混合溶液中含有0.1molCl-和0.2molSO42-,则此溶液中H+的物质的量浓度c(H+)为
A. 1mol/L B. 0.5 mol/L C. 0.6 mol/L D. 1.5 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com