
【题目】NCl3既可用于漂白,又可用于柠檬等水果的熏蒸处理。已知:NCl3熔点为-40℃,沸点为70℃, 95℃以上易爆炸,有刺激性气味,在热水中易水解。实验室可用Cl2和NH4Cl溶液反应制取NCl3。某小组利用如图所示的装置制备NCl3,并探究NCl3的漂白性。

回答下列问题:
(1)仪器M中盛放的试剂为_________。
(2)各装置接口连接的顺序为__________(用小写字母表示)。
(3)当装置B的蒸馏烧瓶中出现较多油状液体后,关闭b处的活塞,应控制水浴加热的温度为_______,装置C的作用为_________。
(4)当装置D的锥形瓶内有较多黄色油状液体出现时,用干燥、洁净的玻璃棒蘸取该液体滴到干燥的红色石蕊试纸上,试纸不褪色;若取该液体滴入50~60℃的热水中,片刻后取该热水再滴到干燥的红色石蕊试纸上,则试纸先变蓝后褪色。结合化学方程式解释该现象:___________________。
(5)在pH=4时电解NH4Cl溶液也可以制得NCl3,然后利用空气流将产物带出电解槽。电解池中产生NCl3的电极为_______(填“阴极”或“阳极”),该电极的电极反应式为________。
(6)NCl3可与NaClO2溶液反应制取ClO2气体,同时产生一种无污染的气体,该反应的化学方程式为__________________。
【答案】 浓盐酸 a、b、c、e、f、d 70~95℃ 吸收尾气HCl并防止倒吸 在热水中发生的反应为NCl3+3H2O![]() 3HClO+NH3↑, NCl3本身无漂白性,但在热水中会水解生成NH3·H2O 使红色石蕊试纸变蓝,而生成的HClO又使其褪色 阳极 3Cl-+NH4+-6e―=NCl3+4H+ 2NCl3+6NaClO=6ClO2↑+6NaCl+N2↑
3HClO+NH3↑, NCl3本身无漂白性,但在热水中会水解生成NH3·H2O 使红色石蕊试纸变蓝,而生成的HClO又使其褪色 阳极 3Cl-+NH4+-6e―=NCl3+4H+ 2NCl3+6NaClO=6ClO2↑+6NaCl+N2↑
【解析】(1)A装置制备氯气,因此仪器M中盛放的试剂为浓盐酸;(2)A装置制备氯气,制备的氯气中含有HCl、水蒸气,用饱和食盐水除去HCl,B装置中Cl2与NH4Cl水溶液在低温下反应得到NCl3,加热蒸馏,再冷凝收集NCl3,最后用氢氧化钠溶液吸收尾气,防止污染空气,故仪器接口连接的顺序为:a、b、c、e、f、d;(3)由于NCl3熔点为-40℃,沸点为70℃, 95℃以上易爆炸,有刺激性气味,在热水中易水解,所以应控制水浴加热的温度为70~95℃,氯气、氯化氢都能引起空气污染,不能直接排放,可以用氢氧化钠溶液吸收,所以装置C的作用为吸收尾气HCl并防止倒吸;(4)NCl3本身无漂白性,与水反应生成次氯酸和氨气,化学方程式:NCl3+3H2O![]() 3HClO+NH3↑,氨气与水反应生成一水合氨,一水合氨电离出氢氧根离子,溶液显碱性,使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色;(5)在pH=4时电解NH4Cl溶液也可以制得NCl3,氮元素化合价从-3价升高到+3价,发生失去电子的氧化反应,则电解池中产生NCl3的电极为阳极,该电极的电极反应式为3Cl-+NH4+-6e-=NCl3+4H+。(6)NCl3可与NaClO2溶液反应制取ClO2气体,同时产生一种无污染的气体,根据原子守恒可知该气体是氮气,反应的方程式为2NCl3+6NaClO=6ClO2↑+6NaCl+N2↑。
3HClO+NH3↑,氨气与水反应生成一水合氨,一水合氨电离出氢氧根离子,溶液显碱性,使红色石蕊试纸变蓝,生成的HClO又使其漂白褪色;(5)在pH=4时电解NH4Cl溶液也可以制得NCl3,氮元素化合价从-3价升高到+3价,发生失去电子的氧化反应,则电解池中产生NCl3的电极为阳极,该电极的电极反应式为3Cl-+NH4+-6e-=NCl3+4H+。(6)NCl3可与NaClO2溶液反应制取ClO2气体,同时产生一种无污染的气体,根据原子守恒可知该气体是氮气,反应的方程式为2NCl3+6NaClO=6ClO2↑+6NaCl+N2↑。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】标准状况下的aLHCl(g)溶于1000g水中,得到的盐酸密度为bg·cm-3,则该盐酸的物质的量浓度是( )
A. ![]() mol·L-1B.
mol·L-1B. ![]() mol·L-1
mol·L-1
C. ![]() mol·L-1D.
mol·L-1D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热测定实验中,用50mL0.50mol/L盐酸和50mL0.55mol/LNaOH溶液进行实验,下列说法不正确的是

A. 改用25mL 0.50mol/L盐酸跟25mL 0.55 mol/L NaOH溶液进行反应,求出的中和热数值和原来相同
B. 酸碱混合时,量筒中NaOH溶液应缓缓倒入小烧杯中,不断用玻璃棒搅拌
C. 装置中的大小烧杯之间填满碎泡沫塑料的作用是保温隔热减少热量损失
D. 实验中应记录测量出反应过程中的最高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性: C>Si | |
B | 食盐水 | 电石 | 溴水 | 乙炔可与溴发生加成反应 | |
C | 浓硝酸 | Al | NaOH溶液 | 铝和浓硝酸反应可生成NO2 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | SO2具有还原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素性质的递变情况错误的是( )
A.B、C、N原子最外层电子数依次增多
B.Na、Mg、Al元素最高正价依次升高
C.Be、Mg、Ca的电子层数依次增多
D.Li、Be、B原子半径依次增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中只含有共价键的是( )
A.NaCl、HCl、H2O、NaOHB.Cl2、Na2S、HCl、SO2
C.Na2O2、H2O2、H2O、O3D.HBr、CO2、H2O、CS2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象能正确反映对应的变化关系的是( )
A. 向一定量的稀硫酸中滴加氢氧化钠

B. 向一定量的H2SO4和MgSO4混合溶液中滴加氢氧化钡溶液

C. 将足量块状MgCO3和MgO粉末分别加入相同质量、相同质量分数的稀盐酸中
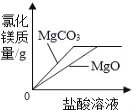
D. 在一定温度下,向不饱和的硝酸钠溶液中不断加入硝酸钠固体,充分搅拌

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:

(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) △H1=+551kJmol-1
反应Ⅲ:S(g)+O2(g)=SO2(g) △H3=-297kJmol-1
反应Ⅱ的热化学方程式:____________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如右图所示,p2______p1(填“>”或“<”),得出该结论的理由是__________。

(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下,将ii补充完整
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+______=______+______+2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mLSO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象,(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4molL-1 KI | amolL-1 KI 0.2molL-1H2SO4 | 0.2molL-1H2SO4 | 0.2molL-1 KI 0.0002 molI2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
① B是A的对比实验,则a=______。
②比较A、B、C,可得出的结论是______。
③实验表明,SO2的歧化反应速率D>A.结合i,ii反应速率解释原因:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com