
| A. | 在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3- | |
| B. | 室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+、NO3-、K+、ClO- | |
| C. | 能使酚酞变红色的溶液中:Na+、K+、AlO2-、CO32- | |
| D. | 在c(HCO3-)=0.1 mol•L-1的溶液中:NH4+、AlO2-、Cl-、NO3- |
分析 A.加入铝粉能产生氢气的溶液,为非氧化性酸或强碱溶液;
B.室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液,为酸或碱溶液;
C.能使酚酞变红色的溶液,显碱性;
D.AlO2-促进HCO3-的电离.
解答 解:A.加入铝粉能产生氢气的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在Fe2+,酸溶液中Al或Fe2+、NO3-发生氧化还原反应,故A错误;
B.室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液,为酸或碱溶液,酸溶液中不能大量存在ClO-,故B错误;
C.能使酚酞变红色的溶液,显碱性,该组离子之间不反应,可大量共存,故C正确;
D.AlO2-促进HCO3-的电离,不能大量共存,故D错误;
故选C.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液中水的电离程度相同 | B. | 水的离子积常数为1.0×10-(a+b) | ||
| C. | CH3COOH的电离常数为$\frac{(1{0}^{-2a})}{c}$ | D. | 两溶液中c(CH3COO-)=c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
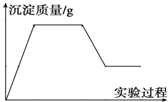 有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2、KCl 中的一种或几种.将该白色固体少量溶于水中,得到无色透明溶液,取100mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示:
有一包白色固体物质,可能含有CuSO4、K2SO4、Na2CO3、Ca (NO3)2、KCl 中的一种或几种.将该白色固体少量溶于水中,得到无色透明溶液,取100mL该溶液先滴加足量硝酸钡溶液,再滴加足量稀硝酸,实验过程中沉淀质量的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
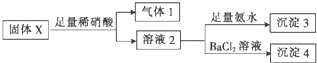
| A. | 气体1可能为SO2和CO2的混合物 | |
| B. | 沉淀3可能为Mg(OH)2和Al(OH)3的混合物 | |
| C. | 沉淀4可能为BaCO3、BaSO3或二者混合物 | |
| D. | 固体粉末X中一定有Na2CO3,可能有KAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别Na2CO3和NaHCO3可用Ba(OH)2或Ca(OH)2溶液 | |
| B. | 除去Na2CO3固体中混有的少量NaHCO3,可采用加热法 | |
| C. | CO2中混有少量HCl、SO2等气体时,可用饱和NaHCO3溶液提纯气体 | |
| D. | 将澄清石灰水滴入NaHCO3溶液中,开始时发生反应的离子方程式为:Ca2++2OH-+2HCO3-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
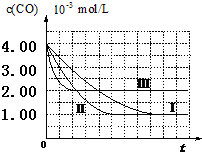 (I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.| 实验编号 | 实验目的 | T/℃ | NO初始浓度mol/L | CO初始浓度mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 探究催化剂比表面积对尾气转化速率的影响 | 6.50×10-3 | 4.00×10-3 | 120 | |
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
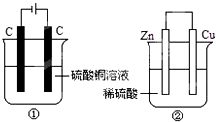 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol•L -1,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A. | 产生气体体积 ①=② | |
| B. | ①中阴极质量增加,②中正极质量减小 | |
| C. | 电极反应式:①中阳极:4OH --4e -═2H2O+O2↑ ②中负极:2H ++2e -═H2↑ | |
| D. | 溶液的pH变化:①减小,②增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com