
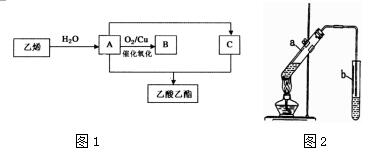
分析 由图可知,乙烯与水发生加成反应生成A为CH3CH2OH,A发生催化氧化生成B为CH3CHO,A与C反应生成乙酸乙酯,C为CH3COOH,以此分析(1)~(3);
(4)①加入2-3块的碎瓷片,防止液体加热沸腾;
②饱和碳酸钠溶液吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度,且乙酸乙酯的密度比水密度小,不溶于水,分层后有机层在上层,导管口应在液面上可防止倒吸.
解答 解:由图可知,乙烯与水发生加成反应生成A为CH3CH2OH,A发生催化氧化生成B为CH3CHO,A与C反应生成乙酸乙酯,C为CH3COOH,
(1)B的结构简式为CH3CHO,故答案为:CH3CHO;
(2)乙烯与水反应生成A的反应类型为加成反应,故答案为:加成反应;
(3)A与C反应生成乙酸乙酯的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O,反应类型为酯化(或取代)反应,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓H_{2}SO_{4}}$CH3COOCH2CH3+H2O;酯化(或取代)反应;
(4)①在试管a中加好相关试剂后,还需要加入2-3块的碎瓷片,其作用是防止暴沸,故答案为:防止暴沸;
②试管b中盛有饱和碳酸钠溶液,生成的乙酸乙酯不溶于水,密度比水小,则乙酸乙酯在该溶液的上层,用分液的方法分离出该产品所需的主要仪器是分液漏斗(烧杯等).试管b中的导管口应在液面上方而不伸入到液面以下,其原因是防止倒吸,
故答案为:上;分液漏斗(烧杯等);防止倒吸.
点评 本题考查有机物的合成及实验,为高频考点,把握有机物的性质、有机反应、制备实验为解答的关键,侧重分析与推断、实验能力的考查,注意混合物分离方法及原理,题目难度不大.


科目:高中化学 来源: 题型:选择题
| W | X | |
| Y | Z |
| A. | X、Y、Z中最简单氢化物稳定性最弱的是Y | |
| B. | Z元素氧化物对应水化物的酸性一定强于Y | |
| C. | X元素形成的单核阴离子还原性强于Y | |
| D. | Z元素单质在化学反应中只表现氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{53}^{131}$I放出射线是一个自发的化学变化过程,射线对人危害很大 | |
| B. | 不同元素的原子构成的分子只含极性共价键 | |
| C. | H2和T2是两种不同的物质,互称为同位素 | |
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取代,4 mol Cl2 | B. | 加成、取代,3 mol Cl2 | ||
| C. | 加成,2 mol Cl2 | D. | 加成、取代,5 mol Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL 2.0 mol/L的醋酸溶液中氢离子为0.2 NA | |
| B. | 标准状况下,11.2L乙醇所含分子数为0.5NA | |
| C. | 71gCl2与足量的氢氧化钠反应,转移的电子数为2NA | |
| D. | 常温常压下,32gO2和O3的混合气体含有的原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠的水解:CO32-+2H2O?H2CO3+2OH- | |
| B. | 钠和CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ | |
| C. | 用食醋溶解水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com