
【题目】常温下,100mL0.1mol·L-1 的H2A 溶液中滴加0.1mol·L-1NaOH溶液,含A元素相关微粒物质的量随pH的变化如图所示。下列说法正确的是
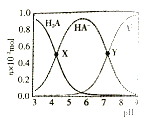
A.将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性
B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大
C.X 点溶液中含A元素的相关离子存在以下关系:c(H2A)+c(HA-)+c(A2-)=0.1mol·L-1
D.Y点溶液中存在以下关系:c(H+) +c(Na+)=c(OH-)+3c(HA-)
【答案】D
【解析】
A.图中曲线分析可知溶液中存在酸H2A的分子,说明H2A为弱酸,则将等浓度等体积的Na2A与H2A溶液混合后,二者恰好发生反应:A2-+H2A=2HA-,根据图示可知NaHA溶液显酸性,A错误;
B.酸或碱的电离抑制水的电离,盐类水解促进水的电离,等体积等浓度的NaOH溶液与H2A溶液混合后,反应恰好产生HA-,溶液为酸性,说明HA-电离程度大于HA-水解程度,抑制水的电离,其溶液中水的电离程度比纯水小,B错误;
C.X点溶液中c(H2A)=c(HA-),根据物料守恒:c(H2A)+c(HA-)+c(A2-)=![]() mol/L≠0.1mol/L,C错误,
mol/L≠0.1mol/L,C错误,
D.根据图象分析,Y点溶液中c(HA-)=c(A2-),溶液中存在电荷守恒:c(Na+)+c(H+)=c(OH-)+ c(HA-)+2c(A2-),则有c(Na+)+c(H+)= c(OH-)+3c(HA-),D正确;
故合理选项是D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某有机物,只可能含有C、H、O三种元素,在标况下,其蒸气的密度是H2的21倍。测得其质量为10.5g,在氧气中充分燃烧,生成33g二氧化碳和13.5g水,求该化合物的分子式,并写出其所有可能结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是![]()
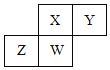
A.最简单气态氢化物的热稳定性:![]() X
X![]() W
W![]() Z
Z
B.最高价氧化物对应的水化物的酸性:![]() W
W![]() Z
Z
C.原子半径:![]() Z
Z![]() Y
Y![]() X
X
D.元素X、Z、W的最高正价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是化学实验室中最常见的有机物,它易溶于水并有特殊香味;B的产量可以衡量一个国家石油化工发展的水平,有关物质的转化关系如图所示![]() 部分反应条件、产物省略
部分反应条件、产物省略![]() :
:
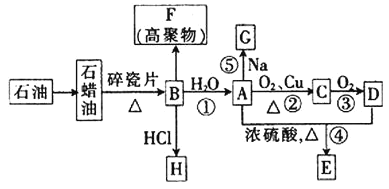
回答下列问题:
![]() 工业上,由石油获得石蜡油的方法称为_________,由石蜡油获得B的方法称为__________。
工业上,由石油获得石蜡油的方法称为_________,由石蜡油获得B的方法称为__________。
![]() ①决定化合物A的化学特性的原子团的名称为______________。
①决定化合物A的化学特性的原子团的名称为______________。
②![]() 到A的反应类型为_______,A到E的反应类型为____________。
到A的反应类型为_______,A到E的反应类型为____________。
③![]() 的分子式为_________;F的结构简式为___________。
的分子式为_________;F的结构简式为___________。
![]() 写出下列反应的化学方程式。
写出下列反应的化学方程式。
反应①:___________________________________________________;
反应②:___________________________________________________;
反应⑤:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W原子最外层电子数是其内层电子数的3倍。下列说法错误的是
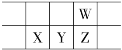
A.原子半径:W<X
B.Y 的最高价氧化物的水化物是强酸
C.气态氢化物热稳定性:Z<W
D.X 的位置为第三周期IVA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素铬(Cr)的几种化合物存在下列转化关系,下列判断不正确的是
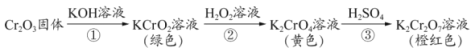
A.反应①表明Cr2O3有酸性氧化物的性质
B.反应②利用了H2O2的氧化性
C.反应②的离子方程式为2CrO2ˉ+3H2O2+2OHˉ=2CrO42ˉ+4H2O
D.反应①②③中铬元素的化合价均发生了变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物X仅由三种短周期元素组成,X隔绝空气加热,可分解为盐A和气体B,有关该反应的物质转换、现象和量的关系如下图所示。

(1)检验盐A中阳离子的方法及现象是____________。
(2)请用双桥法分析并表达化合物X分解时,电子转移的方向和数目____________。
(3)白色沉淀C在紫外光照射下会发生分解,请写出该反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素。根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图________。
(2)写出化合物E2F2的电子式________,化合物ABC的结构式________。
(3)根据题目要求完成以下填空:
①BF32﹣中心原子杂化方式________;CA3中心原子杂化方式________;
②FD42﹣微粒中的键角________; FD3分子的立体构型________。
(4)F元素两种氧化物对应的水化物酸性由强到弱为__________,原因__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. Xe元素的所在族的原子的外围电子排布式均为ns2np6,属于非金属元素
B. 在元素周期表中,s区,d区和ds区的元素都是金属(氢元素除外)
C. 某基态原子核外电子排布图为![]() 它违背了泡利原理
它违背了泡利原理
D. 某外围电子排布为4f75d16s2基态原子,该元素位于周期表中第六周期第ⅢB族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com