
分析 (1)CuSO4溶于水得到蓝色溶液;
(2)该白色沉淀可能是CaCO3,可能是BaCl2和Na2SO4反应生成的BaSO4,也可能是CaCO3和BaSO4;
(3)取实验(1)得到的滤液,向其中通入CO2,产生的白色沉淀是BaCO3.
解答 解:(1)取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液,而CuSO4溶于水得到蓝色溶液,所以原白色粉末中一定不含有CuSO4,
故答案为:CuSO4;
(2)该白色沉淀可能是CaCO3,可能是BaCl2和Na2SO4反应生成的BaSO4,也可能是CaCO3和BaSO4,向其中加入足量的盐酸,沉淀全部溶液,并产生无色气体,BaSO4与盐酸不能反应,说明该白色沉淀是CaCO3,离子方程式为CaCO3+2H+=Ca2++CO2↑+H2O,
故答案为:CaCO3;CaCO3+2H+=Ca2++CO2↑+H2O;
(3)BaCl2溶液与CO2不能发生反应,但CO2和NaOH溶液反应生成碳酸钠和水,碳酸钠和BaCl2反应生成碳酸钡沉淀和氯化钠,离子方程式为CO2+2OH-=CO32-+H2O,CO32-+Ba2+=BaCO3↓,所以可推断原白色粉末中一定还含有BaCl2和NaOH,
故答案为:BaCl2;NaOH;CO2+2OH-=CO32-+H2O、CO32-+Ba2+=BaCO3↓.
点评 本题考查物质的性质与推断,题目难度中等,掌握元素及其化合物的性质、离子方程式的书写是解题的关键,注意BaCl2溶液与CO2不能发生反应.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:推断题
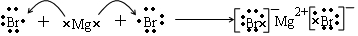 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{6}^{12}$C与${\;}_{6}^{14}$C互为同位素 | B. | 乙烯分子的结构简式:CH2=CH2 | ||
| C. | 氟离子结构示意图: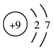 | D. | -OH的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验装置 | 电解质溶液 | 实验现象 | |
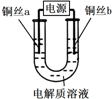 | 5mol/L NaCl溶液 | a极附近 | b极附近 |
| 开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeCl3水解生成的Fe(OH)3胶粒数为NA | |
| B. | 高温下,0.2mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| D. | 标准状况下,11.2 L CO2 与足量Na2O2反应转移的电子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在平衡常数表达式中,反应物浓度用起始浓度,生成物用平衡浓度 | |
| B. | 在任何条件下,化学平衡常数是一个恒定值 | |
| C. | 平衡常数的大小只与温度有关,而与浓度、催化剂等无关 | |
| D. | 改变压强,化学平衡常数不一定发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烷没有同分异构体 | |
| B. | CH(CH3)2CH2CH2CH3的一氯代物有4种 | |
| C. | 二氯苯有3种,则四氯苯有6种 | |
| D. | CH3OH与CH2OH-CH2OH都属于醇,互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com