
(1)量取A mL水样迅速加入固定剂MnSO4溶液与KI碱性溶液,立即塞好胶塞并振荡摇匀,使之反应:2Mn2++O2+4OH-====2MnO(OH)2
(2)滴定:打开胶塞加入适量硫酸即反应:MnO(OH)2+2I-+4H+====Mn2++I2+3H2O
然后用b mol·L-1的NA2S2O3溶液滴定(与I2反应)共消耗V mL(以淀粉为指示剂),其反应是:I2+2![]() ====2I-+
====2I-+![]() 。
。
请回答:
(1)水中溶解氧的质量(mg·L-1)的计算式__________________________。
(2)以淀粉为指示剂,达到终点时,由_________色变为________。
(3)滴定时,滴定管经水洗、蒸馏水洗后立即加入滴定剂NA2S2O3溶液,会导致测定结果_______________。(填“偏高”“偏低”或“无影响”,下同)
(4)滴定前滴定管下端有气泡未排尽,导致测定结果__________________________________。
(5)在记录结果时,滴定前仰视刻度线,滴定后又俯视刻度线,会导致测定结果__________。
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:022
环境监测小组测定水中溶解氧的方法是:
(1)量取a mL水迅速加入固定试剂 溶液和碱性KI溶液(含KOH),立即塞好塞子并振荡均匀使之充分反应,其反应式为:
溶液和碱性KI溶液(含KOH),立即塞好塞子并振荡均匀使之充分反应,其反应式为:
 (此反应极快)
(此反应极快)
(2)测定:开塞后迅速加入适量硫酸(提供 ),使之生成
),使之生成 ,再用
,再用

 溶液滴定(以淀粉溶液为指示剂),消耗了VmL,有关
溶液滴定(以淀粉溶液为指示剂),消耗了VmL,有关
反应为:

(1)水中溶解氧的量(以 为单位)的计算式.(写出计算过程)
为单位)的计算式.(写出计算过程)
(2)滴定时( 和
和 反应),以淀粉为指示剂,终点时溶液由__________色变成___________色.
反应),以淀粉为指示剂,终点时溶液由__________色变成___________色.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:022
环境监测小组测定水中溶解氧的方法是:
(1)量取a mL水迅速加入固定试剂 溶液和碱性KI溶液(含KOH),立即塞好塞子并振荡均匀使之充分反应,其反应式为:
溶液和碱性KI溶液(含KOH),立即塞好塞子并振荡均匀使之充分反应,其反应式为:
 (此反应极快)
(此反应极快)
(2)测定:开塞后迅速加入适量硫酸(提供 ),使之生成
),使之生成 ,再用
,再用

 溶液滴定(以淀粉溶液为指示剂),消耗了VmL,有关
溶液滴定(以淀粉溶液为指示剂),消耗了VmL,有关
反应为:

(1)水中溶解氧的量(以 为单位)的计算式.(写出计算过程)
为单位)的计算式.(写出计算过程)
(2)滴定时( 和
和 反应),以淀粉为指示剂,终点时溶液由__________色变成___________色.
反应),以淀粉为指示剂,终点时溶液由__________色变成___________色.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)量取a mL水样迅速加入固定剂MnSO4溶液与碱性KI溶液,立即塞好胶塞,并振荡摇匀,使之反应。2Mn2++O2+4OH-====2MnO(OH)2 ①
(2)滴定:打开胶塞加入适量硫酸即反应:MnO(OH)2+2I-+4H+====Mn2++I2+3H2O ②
然后用b mol·L-1的Na2S2O3溶液滴定(与I2反应)共消耗V mL(以淀粉为指示剂),其反应是:I2+2S2O![]() ====2I-+S4O
====2I-+S4O![]() ③
③
试完成下列各题:
(1)水中溶解氧的质量(mg·L-1)的计算式________________;
(2)以淀粉作指示剂,达到终点时,由__________色变为色__________;
(3)测定时,滴定管经水洗、蒸馏水洗后加入滴定剂Na2S2O3溶液,导致测定结果会__________(填“偏高”“偏低”或“无影响”);
(4)滴定前滴定管下端有气泡未排除尽,导致测定结果__________。
(5)在记录结果时,滴定前仰视刻度线,滴定后又俯视刻度线,导致测定结果会__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
 =2I-+
=2I-+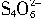
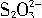 反应)以淀粉为指示剂,终点时溶液由____色变为____色。
反应)以淀粉为指示剂,终点时溶液由____色变为____色。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com