
| A. | 在 2 min 内的反应速率,用 C 表示是 0.4 mol/(L•min) | |
| B. | 分别用 B、C、D 表示化学反应速率其比值是 3:2:1 | |
| C. | 达到化学反应限度时,B 物质转化率为 100% | |
| D. | 向容器中增加 A 的投量,可以加快该反应的速率 |
分析 发生4A(s)+3B(g)?2C(g)+D(g),2min后B减小了1.2mol,v(B)=$\frac{\frac{1.2mol}{2L}}{2min}$=0.3mol•(L•min)-1,反应速率之比等于化学计量数之比,且升高温度、增大浓度会增大反应速率,正逆反应速率均增大,固体不影响反应速率,可逆反应不能进行彻底,以此来解答.
解答 解:A.在2min内的反应速率,v(B)=$\frac{\frac{1.2mol}{2L}}{2min}$=0.3mol•(L•min)-1,用C表示是0.2mol•(L•min)-1,故A错误;
B.反应速率之比等于化学计量数之比,则分别用B、C、D表示化学反应速率,其比值是3:2:1,故B正确;
C.达到化学反应限度时,反应达到平衡状态,B 物质转化率一定小于100%,故C错误;
D.A为固体,不能用A表示的反应速率,故错误;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握反应速率的计算、温度对反应速率的影响等为解答的关键,侧重分析与应用能力的考查,注意A为固体在解答中易忽略,题目难度不大.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有 18 个族 | |
| B. | 1-20 号元素称为短周期元素 | |
| C. | 元素周期表中有 7 个主族,7 个副族 | |
| D. | 零族元素原子最外层均为 8 个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
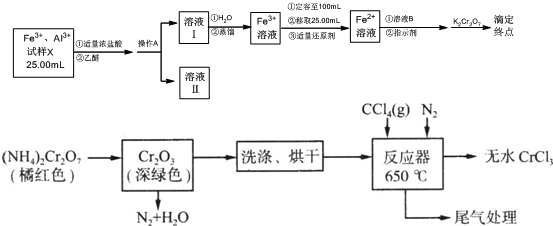
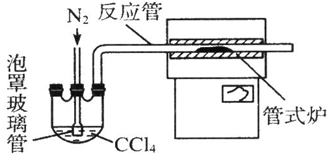
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | ② | ③ | |||
| ④ | ⑤ | ⑥ | ⑦ |
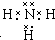 .在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.
.在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所得产物不污染环境,其化学方程式是2NH3•H2O+3H2O2=N2↑+8H2O或2NH3+3H2O2=N2+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
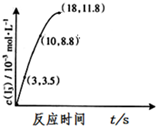 臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色.
臭氧是一种强氧化剂可与碘化钾水溶液发生反应生成氧气和单质碘.向反应后的溶液中滴入酚酞,溶液变为红色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com