
分析 (1)K2SO4是强电解质,完全电离,硫酸根离子应保留;
(2)碳酸钠是强电解质,完全电离出钠离子和碳酸根离子;
(3)硫酸属于强电解质,一步电离出氢离子和硫酸根离子;
(4)氢氧化钡属于二元强碱,一步电离出氢离子和硫酸根离子.
解答 解:(1)硫酸钾为强电解质,在溶液中完全电离出钾离子和硫酸根离子,电离方程式为K2SO4=2K++SO42-,
故答案为:K2SO4=2K++SO42-;
(2)碳酸钠是盐,为强电解质,完全电离,电离方程式为:Na2CO3=2Na++CO32-,
故答案为:Na2CO3=2Na++CO32-;
(3)硫酸属于强电解质,溶液中完全电离,电离方程式为:H2SO4═2H++SO42-,
故答案为:H2SO4═2H++SO42-;
(4)氢氧化钡是强碱,为强电解质,完全电离,电离方程式为:Ba(OH)2 =Ba2++2OH-,
故答案为:Ba(OH)2 =Ba2++2OH-.
点评 本题考查了电离方程式的书写,明确电解质的强弱及电离方程式的书写规则是解本题关键,注意原子团不能拆,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用灼烧的方法可以区分蚕丝和人造纤维 | |
| B. | 医用消毒酒精中乙醇的浓度为95% | |
| C. | 加热能杀死流感病毒是因为蛋白质受热变性 | |
| D. | 食用油反复加热会产生稠环芳香烃等有害物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl | B. | Cl2 | C. | HBr | D. | H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
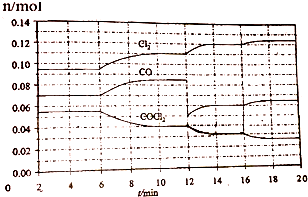
| A. | 1min时以CO表示的逆反应速率小于3min时以CO表示的正反应速率 | |
| B. | 若在6min时改变的条件为升高温度,则反应的平衡常数K增大 | |
| C. | 12min时改变的条件可为减小CO的浓度,16min时改变的条件可为增大反应容器的体积 | |
| D. | 以CO表示在4~5min、10~11min和12~13min时平均反应速率为v(4~5)<v(10~11)<v(12~13) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | 电离常数 |
| HClO | K=3×10-8 |
| H2CO3] | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A. | c(ClO-)>c(HCO3-)>c(OH-) | |
| B. | c(Na+)=c(HCO3-)+c(CO32-)+c(ClO-)+c(HClO) | |
| C. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+C(OH-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-、Na+、NO3-、OH- | B. | HCO3-、Cl-、Na+、K+ | ||
| C. | Ba2+、Cl-、SO42-、K+ | D. | NH4+、K+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgNO3 | B. | BaCl2 | C. | NaOH | D. | Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠固体 | B. | 硫酸铜固体 | C. | 氯化钠溶液 | D. | 硝酸钾溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com