
| A. | 氢氧化铁与氢碘酸反应:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| C. | FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2++4Cl- | |
| D. | 向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓ |
分析 A.三价铁离子具有强的氧化性,能够氧化碘离子生成单质碘;
B.向沸水中滴加饱和的氯化铁溶液得到氢氧化铁胶体;
C.氯气足量二价铁离子、溴离子都被氧化;
D.含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀.
解答 解:A.氢氧化铁与氢碘酸反应,离子方程式:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故A错误;
B.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O═Fe(OH)3(胶体)+3H+,故B错误;
C.向FeBr2溶液中通入足量氯气,亚铁离子和溴离子完全被氧化,反应的离子方程式为:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,故C错误;
D.含Fe2+的溶液与铁氰化钾K3[Fe(CN)6]溶液反应生成具有特征蓝色的铁氰化亚铁沉淀,[Fe(CN)6]3-离子带有3个单位负电荷,正确的离子方程式为:3Fe2++2[Fe(CN)6]3-═Fe3[Fe(CN)6]2↓,故D正确;
故选:D.
点评 本题考查了离子方程式的正误判断,为高考中的高频题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法是解题关键,侧重考查氧化还原反应离子方程式书写的考查.


科目:高中化学 来源: 题型:解答题
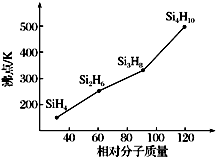 太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池常用材料除单晶硅,还有铜铟镓硒等化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 4N2(g)+6H2O(g);△H
4N2(g)+6H2O(g);△H| 反应 | △H(kJ•mol-1) | 平衡常数(K) |
| 4NH3 (g)+5O2 (g)?4NO (g)+6H2O (g) | -905.5 | 1.1×1026mol•L-1 |
| 4NH3 (g)+4O2 (g)?2N2O (g)+6H2O (g) | -1104.9 | 4.4×1028 |
| 4NH3 (g)+3O2 (g)?2N2 (g)+6H2O (g) | -1269.0 | 7.1×1034L•mol-1 |
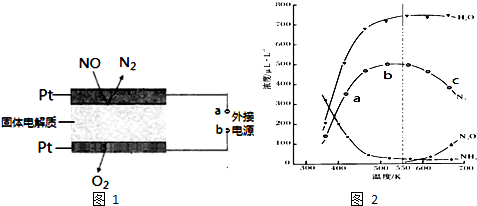
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热法可除去Na2CO3中的NaHCO3 | |
| B. | 硝酸酸化的硝酸银溶液检验Cl- | |
| C. | 可用石灰水区分Na2CO3与NaHCO3溶液 | |
| D. | 热纯碱溶液可除去油污 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>D>B>C | B. | D>A>B>C | C. | D>A>C>B | D. | C>B>A>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | B. | 原子半径:Na<Mg<Al | ||
| C. | 金属性:Na<Mg<Al | D. | 单质的还原性:Al>Mg>Na |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com