
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得浊液中逐渐加入1.00mol/LHCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。
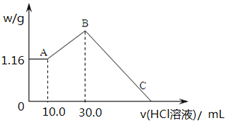
(1)A点的沉淀物的化学式为_________________。
(2)写出A点至B点发生反应的离子方程式:_____________________。
(3)某溶液中溶有MgCl2和AlCl3两种溶质,若把两者分开,应选用的试剂为:______________,________________,________________。
(4)原混合物中NaOH的质量是________g,C点(此时沉淀恰好完全溶解)HCl溶液的体积为_________mL。
【答案】 Mg(OH)2 AlO2-+H++H2O= Al(OH)3↓ NaOH溶液 CO2 稀盐酸 5.20 130
【解析】本题考查化学计算,(1)0~10.0mL之间,沉淀的质量的不变,说明NaOH过量,Al元素以AlO2-形式存在,因此沉淀A是Mg(OH)2;(2)A点以后,继续滴加HCl,发生AlO2-+H++H2O=Al(OH)3↓;(3)利用Al(OH)3表现两性,先加入过量的NaOH溶液,发生Mg2++2OH-=Mg(OH)2↓,Al3++4OH-=AlO2-+2H2O,然后过滤,向沉淀中加入盐酸,Mg(OH)2+2HCl=MgCl2+2H2O,因为Al(OH)3表现两性,溶于强酸,因此向滤液中通入足量CO2,AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,然后过滤,向沉淀中加入盐酸,得到氯化铝;(4)A点的沉淀是Mg(OH)2,根据元素守恒,n(MgCl2)=1.16/58mol=0.02mol,10~30mL之间,发生AlO2-+H++H2O=Al(OH)3↓,根据元素守恒,n(AlCl3)=n(AlO2-)=n(HCl)=(30-10)×10-3×1mol=0.02mol,B点沉淀达到最大,溶液中的溶质为NaCl,n(NaOH)=n(NaCl)=n(HCl)+3n(AlCl3)+2n(MgCl2)=(30×10-3×1+3×0.02+2×0.02)mol=0.13mol,即质量为0.13×40g=5.20g;C点沉淀全部溶解,溶质为NaCl、AlCl3、MgCl2,B到C点发生的反应是Mg(OH)2+2HCl=MgCl2+2H2O,Al(OH)3+3HCl=AlCl3+3H2O,消耗盐酸的物质的量为2n[Mg(OH)2]+3n[Al(OH)3]=(2×0.02+3×0.02)mol=1mol,即消耗盐酸的体积为100ml,C点对应的盐酸的体积为130ml。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,易溶于水,遇酸易分解,Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。工业制备Na2S2O3的反应为: S(s)+Na2SO3(aq)![]() Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。实验室拟用如下实验装置在C中制备Na2S2O3。
Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。实验室拟用如下实验装置在C中制备Na2S2O3。

请回答下列问题:
(1)按如图所示装置进行实验,装置A中反应的化学方程式是______________________。装置C中可观察到溶液先变浑浊,后又澄清,生成的浑浊物质化学式为___________。
(2)装置B的作用为_________;为保证Na2S2O3的产量,实验中通入的SO2不能过量,原因是_________。
(3)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下列装置进行实验:

①实验装置的连接顺序依次________________(填装置的字母代号),装置C中的试剂为____________。
②能证明固体中含有碳酸钠的实验现象是__________________。
(4)若要检验固体硫代硫酸钠工业产品中含有Na2SO3,需先加水配成稀溶液,再依次加入的试剂为_____________________和品红溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、实验现象、解释或结论不正确的是
选项 | 实验操作 | 现象 | 解释或结论 |
A | 将蘸有浓盐酸的玻璃棒与蘸有浓氨水的玻璃棒靠近 | 产生大量白烟 | 氨气和氯化氢反应生成固体物质 |
B | 常温下,将洁净的铁皮放入浓硫酸或浓硝酸中 | 无明显现象 | 常温下,浓硫酸、浓硝酸与铁不反应 |
C | 在导管口点燃纯净的氢气,然后就导管伸入盛满氯气的集气瓶 | 产生苍白色火焰 | 物质燃烧不一定需要氧气 |
D | 加热试管中的氯化铵固体 | 试管底部的固体逐渐减少 | 氯化铵受热分解 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列晶体属于A1型最密堆积的是( )
A. 干冰、氯化钠、金属铜 B. 硫化锌、金属镁、氮化硼
C. 水晶、金刚石、晶体硅 D. 硫化锌、氯化钠、金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
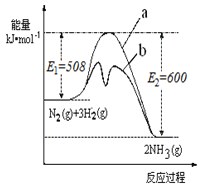
(1)根据如图提供的信息,写出该反应的热化学方程式 ,下图的曲线中 (填“a” 或“b”)表示加入铁触媒(催化剂)的能量变化曲线。
(2)在恒容容器中,下列描述中能说明上述反应已达
平衡的是 。
A.3υ(H2)正=2υ(NH3)逆
B.单位时间内生成n mol N2的同时生成2n molNH3
C.容器内气体的密度不随时间的变化而变化
D.容器内压强不随时间的变化而变化
(3)为了寻找合成NH3的适宜条件,某同学设计了三组实验(如下表),请在下表空格处填入相应的实验条件及数据。
实验编号 | T(℃) | n (N2)/n(H2) | P(MPa) |
ⅰ | 450 | 1/3 | 1 |
ⅱ | 1/3 | 10 | |
ⅲ | 480 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是各种不同密度的硝酸与铁反应(相同温度)时主要还原产物的分布图。请认真读图分析,回答有关问题。
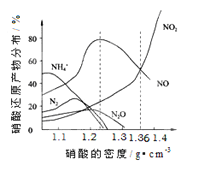
(1)下列叙述中正确的是(填序号)_______________。
A.图中横坐标是硝酸的密度,硝酸的密度越大,其浓度越小。
B.当还原剂和温度相同时,不同浓度的硝酸被还原的产物不是单一的,只是在某浓度时,以某种产物为主而已。
C.硝酸的浓度越大,还原产物中N元素低化合价产物越少
D.当硝酸密度大于1.3g·cm-3时,还原产物主要为NO、NO2
(2)从下图中选择仪器、药品验证由铁和过量1.36 g·cm-3硝酸反应产生的气体中含有NO(N2和O2的用量可自由控制,加热装置和固定装置省略)
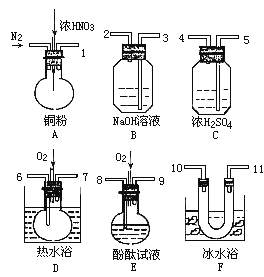
已知:Ⅰ.NO+NO2+2OH-=2NO2-+H2O
Ⅱ.常温下,NO2与N2O4混合存在,在0℃时几乎只有无色的N2O4液体或晶体存在。
①仪器的连接顺序(按左→右连接,填各接口的编号)为______________。
②反应前先通入N2,目的是___________________。
③确认气体中含的现象是__________________。
④装置F的作用是________________。
⑤若从A出来的混合气体中NO2、NO的体积分别为V1mL、V2mL(V1、V2均不为0),且本套装置最终能将氮的氧化物完全吸收,则装置中至少需要冲入氧气的体积为:________mL(相同状态下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z三种主族元素在元素周期表中的位置如图所示。设X的原子序数为a,则下列说法不正确的是

A. Y的原子序数可能为a-17
B. Y与Z的原子序数之和可能为2a
C. Z的原子序数可能为a+31
D. X、Y、Z一定为短周期元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)将一定质量的镁铝合金投入100 mL一定浓度的盐酸中,合金完全溶解。向所得溶液中滴加浓度为5 mol/L的NaOH溶液,生成的沉淀跟加入的NaOH溶液的体积关系如图。(横坐标体积单位是mL,纵坐标质量单位是g)求:
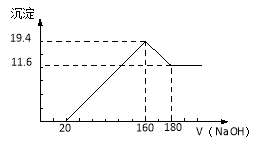
(1)合金中Mg的质量.
(2)所用HCl的物质的量浓度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com