
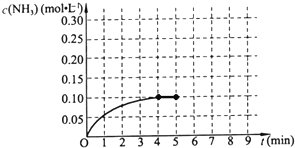
 ��һ�ݻ�Ϊ2L���ܱ������У�����0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��
��һ�ݻ�Ϊ2L���ܱ������У�����0.2mol��N2��0.6mol��H2����һ�������·������·�Ӧ��| ��c |
| ��t |
| 0.1mol/L |
| 4min |
| 3 |
| 2 |
| 3 |
| 2 |
| 0.3mol |
| 0.6mol |
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�����ˮ�еμ�FeCl3��Һ�Ʊ�Fe��OH��3���壺Fe3++3H2O
| ||||
| B��ʵ������Ũ������MnO2��Ӧ��Cl2��MnO2+4H++2Cl-�TCl2��+Mn2++2H2O | ||||
| C����С�մ�����θ����ࣺCO32-+2H+=CO2��+H2O | ||||
| D����FeCl3��Һ��ʴӡˢ��·�壺Fe3++Cu=Fe2++Cu2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���ѻ��ǵ�Һ�嵹���������ڼ��� | ||
| B����ʼ����������ò��������� | ||
C������ʱҺ�岻�����������ݻ���
| ||
| D���������г��ִ�������ʱ��ֹͣ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������������ܶ�Ϊ40 g/L |
| B��SO3�ķֽ���Ϊ20% |
| C������10 min�ڵ�ƽ������Ϊ�ԣ�O2��=0.005 mol?L-1?min-1 |
| D����ѧ��Ӧ���ʣ��ԣ�Ag2SO4��=�ԣ�SO3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ӧ������I-Ũ���й� |
| B��IO-�Ǹ÷�Ӧ�Ĵ��� |
| C������Ӧ�ų�98 kJ������ʱ������1 mol O2 |
| D��v��H2O2��=v��H2O��=v��O2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
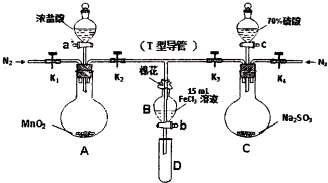
| ���̢�B��Һ�к��е����� | ���̢�B��Һ�к��е����� | |
| �� | ��Fe3+��Fe2+ | ��Fe2+ |
| �� | ����Fe3+����Fe2+ | ��SO42- |
| �� | ��Fe3+��Fe2+ | ��SO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

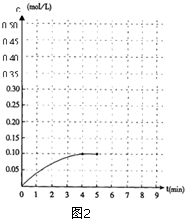 �ڼ���0.2mol��N2��0.6mol ��H2����һ�������·������·�Ӧ��N2 ��g��+3H2��g��?2NH3��g����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ2��
�ڼ���0.2mol��N2��0.6mol ��H2����һ�������·������·�Ӧ��N2 ��g��+3H2��g��?2NH3��g����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�������ͼ2���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
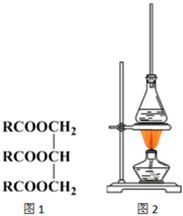 ��֬�Ǹ�֬����ĸ���������ṹ���Ա�ʾΪͼ1��RΪ��ͬ���ţ���������֬��������Ӧ�͵ζ������Բⶨ��֬��ƽ�����������ش��������⣺
��֬�Ǹ�֬����ĸ���������ṹ���Ա�ʾΪͼ1��RΪ��ͬ���ţ���������֬��������Ӧ�͵ζ������Բⶨ��֬��ƽ�����������ش��������⣺�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com