
【题目】下列物质中属于电解质的是( )
A. NaOH溶液 B. 铜 C. 酒精 D. KCl固体
科目:高中化学 来源: 题型:
【题目】肉桂醛是一种实用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。工业上可通过下列反应制备:下列相关叙述正确的是

①B的相对分子质量比A大28
②A、B可用酸性高锰酸钾溶液鉴别
③B中含有的含氧官能团是醛基、碳碳双键
④A、B都能发生加成反应、还原反应
⑤A能发生银镜反应
⑥A中所有碳原子一定处于同一平面
A.①④⑤ B.④⑤⑥ C.②③⑤ D.②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在有机物 ①![]() ;② CH2=CH2;③CH≡CH;④
;② CH2=CH2;③CH≡CH;④![]() ;⑤
;⑤![]() ;
;
⑥![]() ;⑦ CH3CH2CH2CH2Br中能与NaOH溶液反应,但不能与Na2CO3溶液反应的是__________。 (填写上述物质的序号)
;⑦ CH3CH2CH2CH2Br中能与NaOH溶液反应,但不能与Na2CO3溶液反应的是__________。 (填写上述物质的序号)
(2)![]() 的系统命名为:________________________
的系统命名为:________________________
(3)现有下列A、B两组物质:
A组:CH3—CHCl—CH3、![]() 、HCOOH、 ④CH3COOC2H5。
、HCOOH、 ④CH3COOC2H5。
B组:CH3CH2CH2OH、银氨溶液、KOH溶液、④Na2CO3溶液。
A组中____________能跟B组中所有物质都可发生反应。(填写上述物质的序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是________。
2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是________。
A、容器内气体密度保持不变
B、容器内温度不再变化
C、断裂1mol N≡N键的同时,生成6mol N﹣H键
D、反应消耗N2、H2与产生NH3的速率之比1:3:2
(2)已知:①Zn(s)+1/2O2(g) = ZnO(s) △H =-348.3 kJ/mol
②2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H=________ kJ/mol。
(3)已知两个热化学方程式:
C(s)+O2(g)==CO2(g) △H = -393.5kJ/mol
2H2(g)+O2(g)==2H2O(g)△H = -483.6kJ/mol
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是________。
(4)在水溶液中,YO3n-和S2-发生反应的离子方程式如下:YO3n- + 3S2- + 6H+ = Y-+ 3S↓+ 3H2O
①YO3n-中Y的化合价是_____________;
②Y元素原子的最外层电子数是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Cl2生产某些含氯有机物时会生成副产物HCl,利用下列反应可实现氯的循环利用:
4HCl(g) + O2(g)![]() 2Cl2(g) + 2H2O(g) ΔH=-115.6 kJ/mol
2Cl2(g) + 2H2O(g) ΔH=-115.6 kJ/mol
恒温恒容的密闭容器中,充入一定量的反应物发生上述反应,能充分说明该反应达到化学平衡状态的是
A. 氯化氢的转化率不再改变 B. 气体的质量不再改变
C. 断开4 mol H-Cl键的同时生成4 mol H-O键 D. n(HCl)∶n(O2)∶n(Cl2)∶n(H2O)=4∶1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在溶液中可发生如下两个离子反应:Ce4++Fe2+=Fe3++Ce3+、Sn2++2Fe3+=2Fe2++Sn4+。由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是( )
A. Sn2+、Fe2+、Ce3+ B. Sn2+、Ce3+、Fe2+
C. Ce3+、Fe2+、Sn2+ D. Fe2+、Sn2+、Ce3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】消除氮氧化物、二氧化硫等物质造成的污染是目前研究的重要课题。
(1)工业上常用活性炭还原一氧化氮,其反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g)。向容积均为1 L的甲、乙、丙三个恒容恒温容器中分别加入足量的活性炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
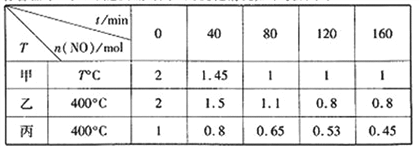
甲容器反应温度T℃______400℃(填“>”“<”或“=”);乙容器中,0~40min内平均反应速率v(CO2)=_____;丙容器中达平衡后NO的物质的量为_________mol。
(2)活性炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如右上图所示:
①A、B、C三点中NO2的转化率最高的是_________点(填“A”或“B”或“C”)。
②计算C点时该反应的压强平衡常数KP=_______MPa
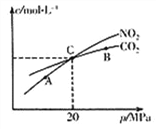 (Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)燃煤烟气脱硫常用如下方法。
方法①:用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫。涉及的部分反应如下:
2CO(g)+SO2(g)=S(g)+2CO2(g) △H1=8.0 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-566.0kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H3=-483.6 1kJ·mol-1
则H2(g)还原SO2(g)生成S(g)和H2O(g)的热化学方程式为_______________________。
方法②:用氨水将SO2转化为NH4HSO3,再氧化成(NH4)2SO4。
实验测得NH4HSO3溶液中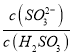 =15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时,
=15,则溶液的pH为________;向该溶液中加氨水使溶液呈中性时, 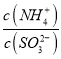 =________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=________。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com