
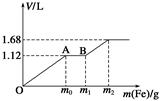
| A.开始时产生的气体为H2 |
| B.AB段产生的反应为置换反应 |
| C.所用混合溶液中c(HNO3)=0.5 mol·L-1 |
| D.参加反应铁粉的总质量m2=5.6 g |
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源:不详 题型:单选题
| A.9.0L | B.13.5L | C.15.7L | D.16.8L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
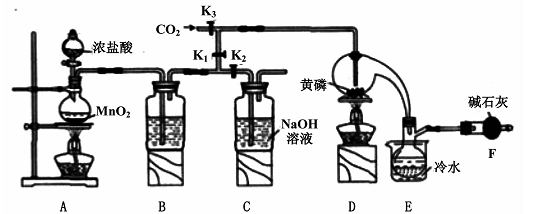

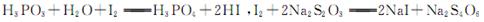 已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。
已知: ,假设测定过程中没有其他反应。根据上述数据,该产品中PCl3的质量分数为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.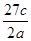 | B.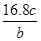 | C. | D. |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K2Cr2O7可以氧化乙醇,可用来鉴别司机是否酒后驾驶 |
| B.污水中铬一般以Cr3+存在,与水中的溶解氧作用可被还原为六价铬 |
| C.人体内六价铬超标,服用维生素C缓解毒性,说明维生素C具有还原性 |
| D.1 mol Cr2O72—得到6 mol电子时,还原产物是Cr3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.60 mL | B.45 mL | C.30 mL | D.15 mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NO+HNO3+9HF,下列有关说法正确的是( )
2NO+HNO3+9HF,下列有关说法正确的是( )| A.反应中NF3是氧化剂,H2O是还原剂 |
| B.反应中被氧化与被还原的原子物质的量之比为2∶1 |
| C.若反应中生成0.2 mol HNO3,则反应共转移0.2 mol e- |
| D.NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com