
【题目】为倡导“低碳”,减小CO2对环境的影响,需对CO2进行创新利用研究.T1℃使,将将9mol CO2和12mol H2充入3L密闭容器中,发生反应CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0,容器中CH3OH的物质的量随时间变化如曲线Ⅰ所示,平衡时容器内压强为p0 . 改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如曲线Ⅱ所示.下列说法错误的是( ) 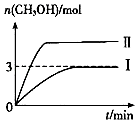
A.曲线Ⅱ对应的条件改变是增大压强
B.T2℃时,上述反应平衡常数为0.52,则T2>T1
C.在T1℃,若起始时向容器充入4.5 mol CO2、6 mol H2 , 平衡时容器内压强P1> ![]()
D.在T1℃,若起始时向容器中充入4.5 mol CO2、5 mol H2、5 mol CH3OH(g)和5 mol H2O(g),则达平衡前v(正)>v(逆)
【答案】B
【解析】解:A.该反应是一个反应前后气体体积减小的放热反应,曲线II到达平衡所需时间较短,说明改变条件时反应速率加快,平衡时甲醇的物质的量增大,说明平衡向正反应方向移动,则改变的条件只能是增大压强,故A正确; B.T1℃时,各物质的平衡浓度分别为:c(CH3OH)=c(H2O)= ![]() =1mol/L,c(CO2)=
=1mol/L,c(CO2)= ![]() =2mol/L,c(H2)=
=2mol/L,c(H2)= ![]() =1mol/L,则平衡常数K=
=1mol/L,则平衡常数K= ![]() =
= ![]() =0.5,T2℃时,上述反应平衡常数为0.52,0.5<0.52,T2℃时平衡常数增大,平衡向正反应方向移动,该反应△H<0,正反应为放热反应,所以T2<T1 , 故B错误;
=0.5,T2℃时,上述反应平衡常数为0.52,0.5<0.52,T2℃时平衡常数增大,平衡向正反应方向移动,该反应△H<0,正反应为放热反应,所以T2<T1 , 故B错误;
C.T1℃时,若起始时向容器由充入4.5molCO2、6mol H2 , 如果转化率相同,则压强是I的一半,实际上,相对于I来说,相当于减小压强,平衡向逆反应方向移动,则压强大于原来的一半,故平衡时容器内压强P1> ![]() ,故C正确;
,故C正确;
D.T1℃时,若起始时向容器中充入 4.5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H20(g),则各物质的浓度分别为:c(CH3OH)=c(H2O)=c(H2)= ![]() ,c(CO2)=
,c(CO2)= ![]() =1.5,则浓度商=
=1.5,则浓度商= 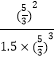 =0.4<0.5,则平衡向正反应方向移动,则达平衡前v(正)>v(逆),故D正确;
=0.4<0.5,则平衡向正反应方向移动,则达平衡前v(正)>v(逆),故D正确;
故选B.
【考点精析】通过灵活运用化学平衡的计算,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%即可以解答此题.


科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列叙述正确的是( )

A. 反应的化学方程式为X(g)+Y(g) = 2Z(g)
B. 反应开始到10 s,用Z表示的反应速率为0.079 mol·L-1·s-1
C. 反应进行到3 s时,v(X)=v(Z)
D. 达到反应限度时,Y的转化率为21%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19世纪中叶,门捷列夫总结了如表所示的元素化学性质的变化情况。请回答:

(1)门捷列夫的突出贡献是________。
A.提出了原子学说
B.提出了分子学说
C.发现了元素周期律
D.发现能量守恒定律
(2)该表变化表明________。
A.事物的性质总是在不断地发生变化
B.元素周期表中最右上角的氦元素是非金属性最强的元素
C.第ⅠA族元素的金属性肯定比同周期的第ⅡA族元素的金属性强
D.物质发生量变到一定程度必然引起质变
(3)按照表中元素的位置,认真观察从第ⅢA族的硼到第ⅦA族的砹连接的一条折线,我们能从分界线附近找到________。
A.耐高温材料 B.新型农药材料
C.半导体材料 D.新型催化剂材料
(4)据报道,美国科学家制得一种新原子![]() X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是________。
X,它属于一种新元素116号元素(元素符号暂用X代替),关于它的推测正确的是________。
A.这种原子的中子数为167
B.它位于元素周期表中第6周期
C.这种元素一定是金属元素
D.这种元素的原子易与氢化合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用CO2和H2生成甲醇,热化学方程式如下: CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=Q1kJmol﹣1
又查资料得知:①CH3OH(l)+ ![]() O2(g)CO2(g)+H2(g)△H=Q2kJmol﹣1
O2(g)CO2(g)+H2(g)△H=Q2kJmol﹣1
②H2O(g)=H2O(I)△H=Q3kJmol﹣1
则表示甲醇的燃烧热的热化学方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X2是最轻的气体,Y、L与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与L组成的最简单化合物的电子式为。
(2)X与M组成的物质为(填“共价”或“离子”)化合物,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为。
(3)Y在周期表中的位置是 , 其含氧酸的化学式为。
(4)L与M形成的化合物中L的化合价是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于溶液的下列说法正确的是( )
A.等体积、对物质的量浓度的NaX和弱酸HX混合后的溶液中:C(Na+)>c(HX)>c(X﹣)>c(H+)>c(OH﹣)
B.等物质的量浓度的下列溶液:①H2CO3②Na2CO3③NaHCO3④(NH4)2CO3中c(CO32﹣)的大小关系为:②>④>③>①
C.往0.1mol/L CH3COOH溶液中通入少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中 ![]() 增大
增大
D.Na2CO3溶液中,2c(Na+)=c(CO32﹣)+c(HCO3﹣)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20mL,0.1mol/L的醋酸溶液中不断滴加0.1mol/L的NaOH溶液,溶液的pH变化曲线如图所示,在滴定过程中,下列关于溶液中离子浓度大小关系的描述不正确的是( ) 
A.a点时:c(CH3COOH)>c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
B.b点时:c(Na+)=c(CH3COO﹣)
C.c点时:c(OH﹣)=c(CH3COOH)+c(H+)
D.d点时:c(Na+)>c(CH3COO﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示。

(1)由图中所给数据进行分析,该反应的化学方程式为_____________;
(2)反应从开始至2分钟,用Z的浓度变化表示的平均反应速率为v(Z)=___________;
(3)2min反应达平衡容器内混合气体的平均相对分子质量比起始时________(填增大、减小或无变化,下同);混合气体密度比起始时____________。
(4)下列措施能加快反应速率的是_______________。
A.恒压时充入He B.恒容时充入He C.恒容时充入X
D.及时分离出Z E.升高温度 F.选择高效的催化剂
(5)下列说法正确的是___________。
A.升高温度改变化学反应的限度
B.已知正反应是吸热反应,升高温度平衡向右移动,正反应速率加快,逆反应速率减慢
C.化学反应的限度与时间长短无关
D.化学反应的限度是不可能改变的
E.增大Y的浓度,正反应速率加快,逆反应速率减慢
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com