
【题目】科学家提出由 WO3 催化乙烯和 2-丁烯合成丙烯的反应历程如图(所有碳原子满足最外层八电子结构)。下列说法不正确的是
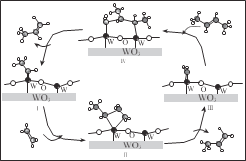
A.乙烯、丙烯和 2-丁烯互为同系物
B.乙烯、丙烯和 2-丁烯的沸点依次升高
C.Ⅲ→Ⅳ中加入的 2-丁烯具有反式结构
D.碳、钨(W)原子间的化学键在Ⅲ→Ⅳ→Ⅰ的过程中未发生断裂
 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在起始压强为80kPa的刚性容器中,发生NO的氧化反应:2NO(g)+O2(g)2NO2(g) △H,该反应的反应历程分两步进行,其速率方程和反应过程中能量变化如下:
①2NO(g)N2O2(g) v1正=k1正c2(NO) v1逆=k1逆c(N2O2)
②N2O2(g)+O2(g)2NO2(g) v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2)
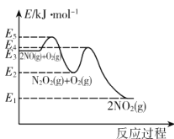
下列说法正确的是
A.NO氧化反应速率快慢的决定步骤的活化能是E5—E3
B.一定温度下,2NO(g)+O2(g)2NO2 (g)平衡常数表达式K=![]()
C.升高温度,NO氧化反应的化学平衡向逆反应方向移动
D.该温度下,将等物质的量的NO和O2混合反应(忽略2NO2N2O4),NO的平衡转化率为40%时,该反应的平衡常数Kp=![]() kPa-1
kPa-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一水硫酸四氨合铜晶体[Cu(NH3)4SO4·H2O,相对分子质量为246]是一种重要的染料及农药中间体。常温下该物质可溶于水,难溶于乙醇。某化学兴趣小组通过以下实验制备一水硫酸四氨合铜晶体并测定其纯度。回答相关问题:
I.实验室制取CuSO4溶液
方案i:铜与浓硫酸加热制备。
方案ii:将铜粉在空气中充分加热至完全变黑,再加稀硫酸即可得到硫酸铜溶液。
(1)请写出方案i反应的化学方程式________________________________________,此方法硫酸的利用率较低的原因是___________________________(写1点)。
(2)实际生产中方案ii常常有紫红色固体未反应,猜想原因可能是___________。
(3)某同学对实验ii进行了改进,其中一种方案是在硫酸和铜的反应容器中滴加H2O2溶液,观察到的现象是_____________________________________。H2O2的沸点为150.2℃。为加快反应需要提高H2O2溶液的浓度,可通过如图将H2O2稀溶液浓缩,增加减压设备的目的除了加快蒸馏速度,还有可能是________________________。

II.一水硫酸四氨合铜晶体的制备
(4)硫酸铜溶液含有一定的硫酸,呈酸性,加入适量NH3·H2O调节溶液pH,产生浅蓝色沉淀,已知其成分为Cu2(OH)2SO4,试写出生成此沉淀的离子反应方程式_______________________。
(5)继续滴加NH3·H2O,会转化成深蓝色溶液。向深蓝色溶液中加入乙醇可析出深蓝色晶体,滴加乙醇的作用可能是________________
A.乙醇可以作还原剂
B.乙醇可以降低该晶体在该溶液中的溶解度
C.乙醇可以作萃取剂
Ⅲ.产品纯度的测定
(6)精确称取mg晶体,加适量水溶解,然后逐滴加入足量NaOH溶液,通入水蒸气将氨全部蒸出,用V1mL0.200mol·L-1的盐酸完全吸收。以甲基橙作指示剂,用0.200mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2mLNaOH溶液。产品纯度的表达式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
(1)第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有_____种不同运动状态的电子。
(2)如图2所示,每条折线表示周期表ⅣA ~ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是___________。判断依据是____________。
(3)CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于_____________晶体。
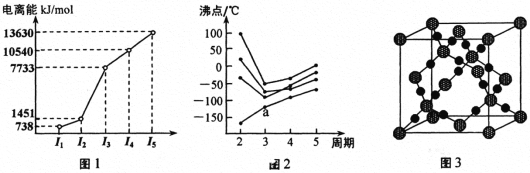
(4)第一电离能介于Al、P之间的第三周期元素有____种。 GaCl3中中心原子的杂化方式为_________,写出与GaCl3结构相同的一种等电子体(写离子)______________。
(5)冰、干冰、碘都是分子晶体,冰的结构具有特殊性,而干冰、碘的晶体具有相似的结构特征,干冰分子中一个分子周围有__________个紧邻分子。 D的醋酸盐晶体局部结构如图,该晶体中含有的化学键是_____________(填字母标号)。
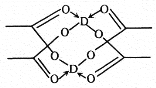
a.极性键 b.非极性键 c.配位键 d.金属键
(6)Fe的一种晶体如甲、乙所示,若按甲虚线方向切乙得到的A~D图中正确的是_____(填字母标号)。
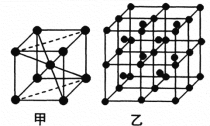
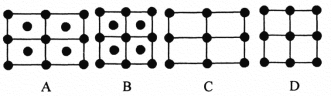
铁原子的配位数是____________,假设铁原子的半径是r cm,该晶体的密度是ρg/cm3 ,则铁的相对原子质量为________________(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于预防和治疗因血小板高聚集引起的心、脑及其他动脉循环障碍疾病的药物。以A为原料合成该药物的路线如图:

(1)A的化学名称是__,C中的官能团除了氯原子,其他官能团名称为__。
(2)A分子中最少有__原子共面。
(3)C生成D的反应类型为__。
(4)A与新制Cu(OH)2反应的化学方程式为__。
(5)物质G是物质A的同系物,比A多一个碳原子,符合以下条件的G的同分异构体共有__种。
①除苯环之外无其他环状结构;②能发生银镜反应。③苯环上有只有两个取代基。
其中核磁共振氢谱中有4个吸收峰,且峰值比为2∶2∶2∶1的结构简式为__。
(6)已知:
![]()
![]()
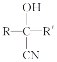 ,写出以苯甲醇为有机原料制备化合物
,写出以苯甲醇为有机原料制备化合物 的合成路线(无机试剂任选)__。
的合成路线(无机试剂任选)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H是优良的溶剂,在工业上可用作洗涤剂、润滑剂,其合成线路:
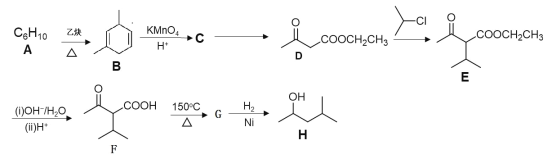
已知:①![]()
②![]()
③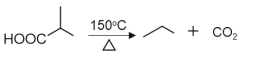
请回答下列问题:
(1)H的名称为___。用*标出F中的手性碳原子__(碳原子上连有4个不同原子或基团时,该碳称为手性碳)
(2)A的结构简式为___。
(3)D→E的化学方程式为___。
(4)F中含有官能团的名称为__。G→H的反应类型为__。
(5)写出符合下列条件的D的同分异构体的结构简式为__。
①能与NaHCO3溶液反应放出CO2②能发生银镜反应③核磁共振氢谱有4组峰且峰面积之比为6∶2∶1∶1
(6)请设计由![]() 和乙烯(CH2=CH2)为起始原料,制备
和乙烯(CH2=CH2)为起始原料,制备![]() 的合成路线__(无机试剂任选)。
的合成路线__(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用废铜屑(含铜、铝等)制备CuSO4·5H2O晶体,制备流程如图:
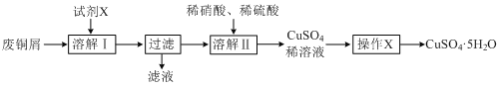
(1)“溶解Ⅰ”过程中所用试剂X为___。(填写试剂名称)
(2)“溶解Ⅱ”发生反应的离子方程式为___。
(3)“操作X”包括___、过滤、无水乙醇洗涤、低温干燥。
(4)某种杀菌剂中含CuSO4和Cu(OH)2,为测定其组成,兴趣小组设计如下实验:取一定量的杀菌剂,将其溶于足量的稀盐酸中,然后向其中加入足量的BaCl2溶液,过滤干燥后得白色固体2.33g。然后向滤液中滴加1.00mol·L-1的Na2H2Y(EDTA)溶液,反应至终点时消耗Na2H2Y溶液30.00 mL(离子方程式为Cu2++H2Y2-=CuY2-+2H+)。
①由准确称量后的EDTA固体配制100mL1.00mol·L-1的EDTA溶液所需的玻璃仪器除烧杯、胶头滴管外还有___。
②通过计算确定杀菌剂中CuSO4和Cu(OH)2的物质的量之比___(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利巴韦林是一种成熟的广谱抗病毒药物,临床上证明它对新型冠状病毒有明显抑制作用。其一条合成路线如下:

已知:①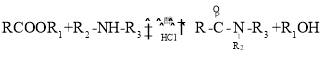 (R代表H或其他基团)
(R代表H或其他基团)
②![]()
回答下列问题:
(1)A的名称为_______________,F中的含氧官能团名称为___________________。
(2)反应I因为反应物用量控制不当,可能会产生副产物,其结构简式为_________,反应I的溶剂使用乙醇而不用甲醇,理由是_______________________________________。
(3)反应II的反应类型为______________。
(4)反应III的反应方程式为_____________________________________________。
(5)G是A的同分异构体,1molG与足量NaHCO3反应生成标准状况下44.8LCO2,符合该条件的G共有_______种。
(6)设计以甘油、乙醇和![]() 为原料制备
为原料制备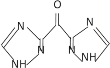 的合成路线_____________(无机试剂任选)。
的合成路线_____________(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com