
| A. |  蒸发食盐水 | B. |  用量筒量取液体 | C. | 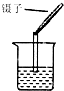 测溶液的pH | D. |  干燥NH3 |
分析 A.外焰温度最高;
B.100mL量筒精确到1mL;
C.不能将pH试纸伸入待测液中,以免污染待测液;
D.氨气可用碱石灰干燥.
解答 解:A.外焰温度最高,应用外焰加热,故A错误;
B.100mL量筒精确到1mL,无法量取9.5mL液体,故B错误;
C.用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.不能将pH试纸伸入待测液中,以免污染待测液,故C错误;
D.氨气呈碱性,氨气可用碱石灰干燥,故D正确.
故选D.
点评 本题考查化学实验方案的评价,难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| B. | 2.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.04NA | |
| C. | 7.8g Na2S和Na2O2的固体混合物中含有的阴离子数等于0.1NA | |
| D. | 常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1s电子云界面图是一个球面,电子云中的每个小黑点代表一个电子 | |
| B. | NaH中的σ键是由两个原子的s、p轨道以“头碰头”方式重叠形成的 | |
| C. | 对于组成结构相似的分子,一定是相对分子质量越大,熔、沸点越高 | |
| D. | 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 56gN2和CO的混合气体中含有的原子总数目为2NA | |
| B. | 标准状况下,11.2L乙醇中含有的分子数目为0.5NA | |
| C. | 1L1mol•L-1 MgCl2溶液中含有的氯离子数目为NA | |
| D. | 2.7gAl粉在足量的Cl2中完全燃烧转移的电子数目为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | |
| 步骤3:取适量步骤1中的沉淀于试管中,取适量步骤1中的沉淀于试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中. | |
| 步骤4:取适量滤液于烧杯中,用pH计测其 pH值 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com