

| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
 ��
�� ��
��| 2.0��2.0 |
| 2.0��8.5 |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| ||||
|
| 4 |
| 3 |
| ||
| 2mol |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�



| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| CO | H2O | CO2 | H2 |
| 0.5mol | 8.5mol | 2.0mol | 2.0mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ϳ�������Ҫ�ɷ���һ����̼�������������ںϳɶ����ѵ����ȼ�ϡ�����Ȼ����úϳ��������п��ܷ����ķ�Ӧ�У�
�� CH4(g)��H2O(g)![]() CO(g)��3H2(g) ��H1����206.1 kJ/mol
CO(g)��3H2(g) ��H1����206.1 kJ/mol
�� CH4(g)��CO2(g)![]() 2CO(g)��2H2(g) ��H2����247.3 kJ/mol
2CO(g)��2H2(g) ��H2����247.3 kJ/mol
�� CO(g)��H2O(g)![]() CO2(g)��H2(g) ��H3
CO2(g)��H2(g) ��H3
��ش��������⣺
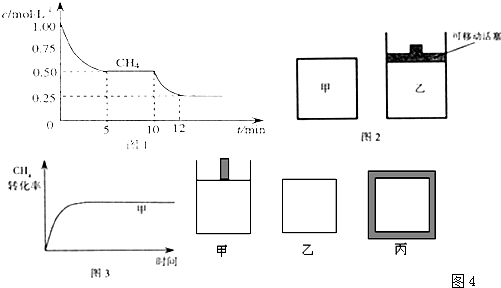
�� ��һ�ܱ������н��з�Ӧ�٣����CH4�����ʵ���Ũ���淴Ӧʱ��ı仯��ͼ1��ʾ����Ӧ���е�ǰ5 min�ڣ� v(H2)�� �� ��10 minʱ���ı��������������� �� ��
![]()

�� ��ͼ2��ʾ���ڼס����������зֱ��������ʵ�����CH4��CO2��ʹ�ס�����������ʼ�ݻ���ȡ�����ͬ�¶��·�����Ӧ�ڣ���ά�ַ�Ӧ�������¶Ȳ��䡣��֪��������CH4��ת������ʱ��仯��ͼ����ͼ3��ʾ������ͼ3�л�����������CH4��ת������ʱ��仯��ͼ��

�� ��Ӧ���Ц�H3�� �� ��800��ʱ����Ӧ�۵Ļ�ѧƽ�ⳣ��K��1.0��ijʱ�̲�ø��¶��µ��ܱ������и����ʵ����ʵ������±���
| CO | H2O | CO2 | H2 |
| 0.5 mol | 8.5 mol | 2.0 mol | 2.0 mol |
��ʱ��Ӧ���������淴Ӧ���ʵĹ�ϵʽ�� �� ������ţ���
a��v(��)��v(��) b��v(��)��v(��) c��v(��)��v(��) d�����ж�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com