
分析 可设出过氧化钠的质量为x,氧化钠的质量为y,利用化学方程式中物质质量比关系求出生成的氢氧化钠的质量及放出的氧气的质量,求出溶液的总质量,列出方程组求解即可.
解答 解:设混合物中含有过氧化钠的质量为x,氧化钠的质量为y,则:
2Na2O2 +2H2O=4NaOH+O2↑
156 160 32
x $\frac{160x}{156}$ $\frac{32x}{156}$
Na2O+H2O=2NaOH
62 80
y $\frac{80y}{62}$
可得方程组:$\left\{\begin{array}{l}{x+y=70}\\{\frac{160x}{156}+\frac{80y}{62}=(70+98-\frac{32x}{156})×50%}\end{array}\right.$,
解得:x=39g、y=31g,
答:过氧化钠的质量为39g,氧化钠的质量为31g.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用方法,试题培养了学生的化学计算能力.


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
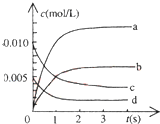 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器内,800℃时反应:2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2与盐酸 Cu(OH)2与醋酸 | |
| B. | BaCl2溶液与Na2SO4溶液 Ba(OH)2溶液与Na2SO4溶液 | |
| C. | NaHCO3溶液与NaHSO4溶液 Na2CO3溶液与NaHSO4溶液 | |
| D. | 石灰石与硝酸 生石灰与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同


| A. | (1)(2)(4)(6) | B. | (2)(3)(5) | C. | (1)(4)(5)(8) | D. | (1)(2)(5)(8) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
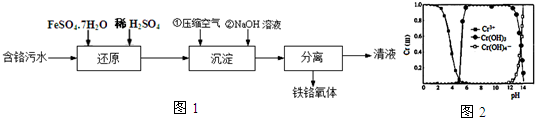
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com