
ΓΨΧβΡΩΓΩ”–ΙΊ¥ΏΜ·ΦΝΒΡ¥ΏΜ·ΜζάμΒ»Έ ΧβΩ…“‘¥”ΓΑ““¥Φ¥ΏΜ·―θΜ· Β―ιΓ±ΒΟΒΫ“Μ–©»œ Ε,Ρ≥ΫΧ Π…ηΦΤΝΥ»γΆΦΥυ ΨΉΑ÷Ο(Φ–≥÷ΉΑ÷ΟΒ»“― Γ¬‘),Τδ Β―ι≤ΌΉςΈΣ:œ»Α¥ΆΦΑ≤ΉΑΚΟΉΑ÷Ο,ΙΊ±’Μν»ϊaΓΔbΓΔc,‘ΎΆ≠ΥΩΒΡ÷–Φδ≤ΩΖ÷Φ”»»Τ§ΩΧ,»ΜΚσ¥ρΩΣΜν»ϊaΓΔbΓΔc,Ά®ΙΐΩΊ÷ΤΜν»ϊaΚΆb,Εχ”–ΫΎΉύ(Φδ–Σ–‘)ΒΊΆ®»κΤχΧε,Φ¥Ω…‘ΎM¥ΠΙέ≤λΒΫΟςœ‘ΒΡ Β―ιœ÷œσΓΘ ‘ΜΊ¥π“‘œ¬Έ Χβ:

Θ®1Θ©A÷–ΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ:_____________________________________,
BΒΡΉς”Ο:_____________________;C÷–»»Υ°ΒΡΉς”Ο:________________________________ΓΘ
(2)M¥ΠΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ________________________________ΓΘ
(3)¥”MΙή÷–Ω…Ιέ≤λΒΫΒΡœ÷œσ:_________________________________ΓΘ
(4) Β―ιΫχ––“ΜΕΈ ±ΦδΚσ,»γΙϊ≥ΖΒτΨΤΨΪΒΤ,Ζ¥”Π__(ΧνΓΑΡήΓ±ΜρΓΑ≤ΜΡήΓ±)ΦΧ–χΫχ––,Τδ‘≠“ρ «______________________________________________________________________ΓΘ
(5)―ι÷Λ““¥Φ―θΜ·≤ζΈοΒΡΜ·―ßΖΫΖ® «____________________________ΓΘ
ΓΨ¥πΑΗΓΩ 2H2O2![]() 2H2O+O2Γϋ Η…‘οO2 ΙD÷–““¥Φ±δΈΣ’τΤχΫχ»κM≤ΈΦ”Ζ¥”Π,”ΟΥ°‘ΓΦ”»» Ι““¥ΦΤχΝςΫœΤΫΈ» 2CH3CH2OH+O2
2H2O+O2Γϋ Η…‘οO2 ΙD÷–““¥Φ±δΈΣ’τΤχΫχ»κM≤ΈΦ”Ζ¥”Π,”ΟΥ°‘ΓΦ”»» Ι““¥ΦΤχΝςΫœΤΫΈ» 2CH3CH2OH+O2![]() 2CH3CHO+2H2O ή»»≤ΩΖ÷ΒΡΆ≠ΥΩΫΜΧφ≥ωœ÷±δΚΎΓΔ±δΚλΒΡœ÷œσ Ρή ““¥ΦΒΡ¥ΏΜ·―θΜ·Ζ¥”Π «Ζ≈»»Ζ¥”Π,Ζ¥”ΠΖ≈≥ωΒΡ»»ΝΩΡήΈ§≥÷Ζ¥”ΠΦΧ–χΫχ–– Β―ιΫα χΚσ,–Εœ¬ΉΑ÷ΟF÷– Δ”–…ΌΝΩ’τΝσΥ°ΒΡ ‘Ιή,¥”÷–»Γ≥ω…Ό–μ»ή“ΚΉω“χΨΒΖ¥”Π Β―ι[“≤Ω… Ι÷°”κ–¬÷ΤCu(OH)2–ϋΉ«“ΚΖ¥”Π],ά¥÷ΛΟς““»©ΒΡ…ζ≥…
2CH3CHO+2H2O ή»»≤ΩΖ÷ΒΡΆ≠ΥΩΫΜΧφ≥ωœ÷±δΚΎΓΔ±δΚλΒΡœ÷œσ Ρή ““¥ΦΒΡ¥ΏΜ·―θΜ·Ζ¥”Π «Ζ≈»»Ζ¥”Π,Ζ¥”ΠΖ≈≥ωΒΡ»»ΝΩΡήΈ§≥÷Ζ¥”ΠΦΧ–χΫχ–– Β―ιΫα χΚσ,–Εœ¬ΉΑ÷ΟF÷– Δ”–…ΌΝΩ’τΝσΥ°ΒΡ ‘Ιή,¥”÷–»Γ≥ω…Ό–μ»ή“ΚΉω“χΨΒΖ¥”Π Β―ι[“≤Ω… Ι÷°”κ–¬÷ΤCu(OH)2–ϋΉ«“ΚΖ¥”Π],ά¥÷ΛΟς““»©ΒΡ…ζ≥…
ΓΨΫβΈωΓΩ(1)A÷– «Ιΐ―θΜ·«β‘ΎΕΰ―θΜ·ΟΧ¥ΏΜ·Ής”Οœ¬…ζ≥…Υ°ΚΆ―θΤχΘ§Ζ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ2H2O2 ![]() 2H2O+O2ΓϋΘΜB «Έϋ ’―θΤχ÷–ΒΡΥ°’τΤχΘΜC÷–Υ°‘ΓΦ”»»““¥ΦΒΟΒΫΤχΝςΫœΤΫΈ»ΒΡ““¥Φ’τΤχΫχ»κMΘ§Ι ¥πΑΗΈΣΘΚ2H2O2
2H2O+O2ΓϋΘΜB «Έϋ ’―θΤχ÷–ΒΡΥ°’τΤχΘΜC÷–Υ°‘ΓΦ”»»““¥ΦΒΟΒΫΤχΝςΫœΤΫΈ»ΒΡ““¥Φ’τΤχΫχ»κMΘ§Ι ¥πΑΗΈΣΘΚ2H2O2 ![]() 2H2O+O2ΓϋΘΜΗ…‘ο―θΤχ(ΜρΈϋ ’―θΤχ÷–ΒΡΥ°)ΘΜ ΙD÷–““¥Φ±δΈΣ’τΤχΫχ»κM÷–≤ΈΦ”Ζ¥”ΠΘ§”ΟΥ°‘ΓΦ”»» Ι““¥ΦΤχΝςΫœΤΫΈ»ΘΜ
2H2O+O2ΓϋΘΜΗ…‘ο―θΤχ(ΜρΈϋ ’―θΤχ÷–ΒΡΥ°)ΘΜ ΙD÷–““¥Φ±δΈΣ’τΤχΫχ»κM÷–≤ΈΦ”Ζ¥”ΠΘ§”ΟΥ°‘ΓΦ”»» Ι““¥ΦΤχΝςΫœΤΫΈ»ΘΜ
(2)‘ΎΆ≠Ής¥ΏΜ·ΦΝΓΔΦ”»»ΧθΦΰœ¬Θ§““¥ΦΡή±Μ―θΤχ―θΜ·…ζ≥…““»©ΚΆΥ°Θ§Υυ“‘M¥ΠΖΔ…ζΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ ΫΈΣ2CH3CH2OH+O2![]() 2CH3CHO+2H2OΘ§Ι ¥πΑΗΈΣΘΚ2CH3CH2OH+O2
2CH3CHO+2H2OΘ§Ι ¥πΑΗΈΣΘΚ2CH3CH2OH+O2![]() 2CH3CHO+2H2OΘΜ
2CH3CHO+2H2OΘΜ
(3)““¥ΦΒΡ¥ΏΜ·―θΜ·Ζ¥”Π÷–Θ§Ϋπ τΆ≠Ής¥ΏΜ·ΦΝΘ§’φ’ΐΚΆ““¥ΦΖ¥”ΠΤπΒΫ―θΜ·Ής”ΟΒΡ «―θΜ·Ά≠Θ§ Β―ιΙΐ≥Χ÷–Ά≠Άχ≥ωœ÷ΚΎ…ΪΘ§ «”…”ΎΆ≠ΚΆ―θΤχΖ¥”Π…ζ≥…―θΜ·Ά≠Θ§Ζ¥”ΠΒΡΖΫ≥Χ ΫΈΣ2Cu+O2![]() 2CuOΘ§Ά≠Άχ”…ΚΎ…Ϊ±δ≥…Κλ…Ϊ «”…”Ύ““¥ΦΚΆ―θΜ·Ά≠Ζ¥”Π…ζ≥…Ά≠Θ§Ζ¥”ΠΒΡΖΫ≥Χ ΫΈΣCH3CH2OH+CuO
2CuOΘ§Ά≠Άχ”…ΚΎ…Ϊ±δ≥…Κλ…Ϊ «”…”Ύ““¥ΦΚΆ―θΜ·Ά≠Ζ¥”Π…ζ≥…Ά≠Θ§Ζ¥”ΠΒΡΖΫ≥Χ ΫΈΣCH3CH2OH+CuO![]() CH3CHO+Cu+H2OΘ§“ρ¥Υ ή»»≤ΩΖ÷ΒΡΆ≠ΥΩΫΜΧφ≥ωœ÷±δΚΎΓΔ±δΚλΒΡœ÷œσΘ§Ι ¥πΑΗΈΣΘΚ ή»»≤ΩΖ÷ΒΡΆ≠ΥΩΫΜΧφ≥ωœ÷±δΚΎΓΔ±δΚλΒΡœ÷œσΘΜ
CH3CHO+Cu+H2OΘ§“ρ¥Υ ή»»≤ΩΖ÷ΒΡΆ≠ΥΩΫΜΧφ≥ωœ÷±δΚΎΓΔ±δΚλΒΡœ÷œσΘ§Ι ¥πΑΗΈΣΘΚ ή»»≤ΩΖ÷ΒΡΆ≠ΥΩΫΜΧφ≥ωœ÷±δΚΎΓΔ±δΚλΒΡœ÷œσΘΜ
(4)≥ΖΒτΨΤΨΪΒΤΘ§Ζ¥”Π»‘Ϋχ––Θ§ «“ρ¥ΦΒΡ¥ΏΜ·―θΜ·Ζ¥”Π «Ζ≈»»Ζ¥”ΠΘ§Ζ≈≥ωΒΡ»»ΝΩ¬ζΉψΖ¥”ΠΥυ–ηΈ¬Ε»Θ§Ι ¥πΑΗΈΣΘΚΡήΘΜ““¥ΦΒΡ¥ΏΜ·―θΜ·Ζ¥”Π «Ζ≈»»Ζ¥”ΠΘ§Ζ¥”ΠΖ≈≥ωΒΡ»»ΝΩΡήΈ§≥÷Ζ¥”ΠΦΧ–χΫχ––ΘΜ
(5)““¥Φ±Μ―θΜ·ΈΣ““»©Θ§““»©Κ§”–»©ΜυΘ§ΨΏ”–ΜΙ‘≠–‘Θ§Ρή±Μ“χΑ±»ή“ΚΜρ–¬÷Τ«β―θΜ·Ά≠–ϋΉ«“Κ―θΜ·Θ§“ρ¥Υ―ι÷Λ““¥Φ―θΜ·≤ζΈοΒΡΜ·―ßΖΫΖ® «ΘΚ Β―ιΫα χΚσΘ§–Εœ¬ΉΑ÷ΟF÷– Δ”–…ΌΝΩ’τΝσΥ°ΒΡ ‘Ιή÷–Θ§Φ”»κ–¬÷ΤΒΡ“χΑ±»ή“ΚΥ°‘ΓΦ”»»Θ§Ιέ≤λ ‘Ιή±Ύ…œ”–ΙβΝΝΒΡ“χΨΒ…ζ≥…Θ§Μρ»Γ…ΌΝΩΒΡ―θΜ·≤ζΈο”Ύ ‘Ιή÷–Θ§Φ”»κ–¬÷ΤΒΡ«β―θΜ·Ά≠–ϋΉ«“ΚΦ”»»Θ§Ιέ≤λ”–Κλ…ΪΒΡ≥ΝΒμ…ζ≥…Θ§Ι ¥πΑΗΈΣΘΚ Β―ιΫα χΚσΘ§–Εœ¬ΉΑ÷ΟF÷– Δ”–…ΌΝΩ’τΝσΥ°ΒΡ ‘ΙήΘ§¥”÷–»Γ≥ω…Ό–μ»ή“ΚΉω“χΨΒΖ¥”Π Β―ι[“≤Ω… Ι÷°”κ–¬÷ΤCu(OH)2–ϋΉ«“ΚΖ¥”Π]Θ§ά¥÷ΛΟς““»©ΒΡ…ζ≥…ΓΘ



| ΡξΦΕ | ΗΏ÷–ΩΈ≥Χ | ΡξΦΕ | ≥θ÷–ΩΈ≥Χ |
| ΗΏ“Μ | ΗΏ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ“Μ | ≥θ“ΜΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏΕΰ | ΗΏΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θΕΰ | ≥θΕΰΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
| ΗΏ»ΐ | ΗΏ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ | ≥θ»ΐ | ≥θ»ΐΟβΖ―ΩΈ≥ΧΆΤΦωΘΓ |
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩάκΉ”ΖΫ≥Χ ΫCO32-+ 2H+ = H2O + CO2Γϋ÷–ΒΡCO32-¥ζ±μΒΡΈο÷ Ω…“‘ «
AΘ°CaCO3 BΘ°NaHCO3 CΘ°Na2CO3 DΘ°BaCO3
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœρ5OmL1mol/LΒΡAl2(SO4)3»ή“Κ÷–Φ”»κ“ΜΕ®ΝΩΒΡΫπ τΡΤΘ§≥δΖ÷Ζ¥”ΠΚσΘ§Ε‘ΗΟ»ή“ΚΒΡΖ÷ΈωΚœάμΒΡ «
ΔΌΩ…ΡήΈω≥ωΝμ“Μ÷÷”–Ϋπ τΙβ‘σΒΡΙΧΧε ΔΎΩ…ΡήΈό≥ΝΒμΈω≥ω
ΔέΩ…Ρή”–7.8g≥ΝΒμΈω≥ω ΔήΩ…ΡήΈω≥ω3.9≥ΝΒμ
A. ΔΎΔέΔή B. ΔέΔή C. ΔΌΔέ D. ΔΌΔΎΔέΔή
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΟΨΦΑΤδΚœΫπ «“Μ÷÷”ΟΆΨΚήΙψΒΡΫπ τ≤ΡΝœΘ§ΡΩ«Α άΫγ…œ60%ΒΡΟΨ «¥”ΚΘΥ°÷–Χα»ΓΒΡΓΘ÷ς“Σ≤Ϋ÷η:
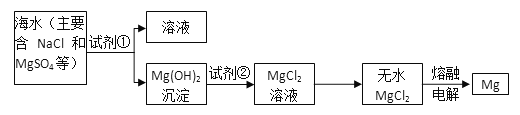
‘ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©ΈΣΝΥ ΙMgSO4ΉΣΜ·ΈΣMg(OH)2Θ§ ‘ΦΝΔΌΩ…“‘―Γ”Ο__________________________ΘΜ
Θ®2Θ©Φ”»κ ‘ΦΝΔΌΚσΘ§ΡήΙΜΖ÷άκΒΟΒΫMg(OH)2≥ΝΒμΒΡΖΫΖ® «____________________ΘΜ
Θ®3Θ© ‘ΦΝΔΎΩ…“‘―Γ”Ο_______ΘΜΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣΘΚ__________________________ΘΜ
Θ®4Θ©ΈόΥ°MgCl2‘Ύ»έ»ΎΉ¥Χ§œ¬Θ§Ά®ΒγΚσΜα≤ζ…ζMgΚΆCl2Θ§–¥≥ωΗΟΖ¥”ΠΒΡΜ·―ßΖΫ≥Χ Ϋ________________________ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩœ¬Ν–”–ΜζΈοΟϋΟϊ’ΐ»ΖΒΡ «( )
A. 2©¹““Μυ©¹1©¹±ϊ¥Φ
B. 3Θ§3©¹ΕΰΦΉΜυ©¹2©¹Έλœ©
C. 3©¹ΦΉΜυ©¹2Θ§3©¹Εΰ““ΜυΈλΆι
D. 2©¹““Μυ©¹1©¹¬»ΈλΆι
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΆ®ΙΐΜ·―ßΖ¥”Π≤ΜΡή Βœ÷ΒΡ «Θ® Θ©
A.…ζ≥…“Μ÷÷–¬άκΉ”
B.…ζ≥…“Μ÷÷–¬Ζ÷Ή”
C.…ζ≥…“Μ÷÷–¬‘≠Ή”
D.…ζ≥…“Μ÷÷–¬ΒΞ÷
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ Β―ι “≤…”Ο≤ΜΆ§ΒΡ Β―ιΉΑ÷Ο―–ΨΩ±Ϋ”κ“ΚδεΒΡΖ¥”Πάύ–Ά≤Δ÷Τ»Γ…ΌΝΩδε±ΫΓΘ
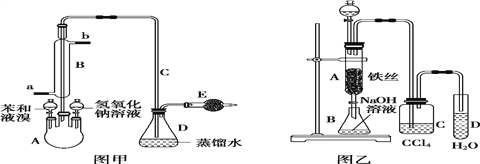
Δώ.»τ”ΟΆΦΦΉΉΑ÷ΟΫχ––÷Τ±Η Β―ιΘ§ΜΊ¥πœ¬Ν–Έ Χβ:
(1)A ÷–‘Λœ»–ηΦ”»κΒΡ ‘ΦΝ «___________Θ§E ÷––ηΦ”»κΒΡ ‘ΦΝ «____________ΓΘ
(2)“«Τς B ΒΡΉς”Ο «_________Θ§__________________ΓΘ
Δρ.»τ”ΟΆΦ““ΉΑ÷ΟΫχ––÷Τ±Η Β―ιΘ§ΜΊ¥πœ¬Ν–Έ Χβ:
(1)C ÷– ΔΖ≈ CCl4 ΒΡΉς”Ο_________ΘΜ
(2) Β―ιΫα χ ±Θ§¥ρΩΣ A œ¬ΕΥΒΡΜν»ϊΘ§»ΟΖ¥”Π“ΚΝς»κ B ÷–Θ§≥δΖ÷’ώΒ¥Θ§–¥≥ω”–ΙΊΒΡάκΉ”ΖΫ≥Χ ΫΘΚ
________________________Θ§»ΜΚσ”Ο__________________(Χν“«ΤςΟϊ≥Τ)Ζ÷άκ≥ωδε±Ϋ(»‘Κ§”–…ΌΝΩ±Ϋ)ΘΜ
(3)Ζ¥”ΠΆξ±œΚσΘ§œρ ‘Ιή D ÷–ΒΈΦ” AgNO3 »ή“ΚΘ§________________(Χνœ÷œσ)Θ§¥Υœ÷œσΥΒΟς”…±Ϋ”κ“ΚδεΜώΒΟδε±ΫΒΡΖ¥”Π τ”Ύ___________________________(Χν”–ΜζΖ¥”Πάύ–Ά)ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩΩΤ―ßΦ“ΫΪ ·ΡΪ‘ΎΖζΜ«Υα÷–ΓΑ»ήΫβΓ±÷ΤΒΟ ·ΡΪœ©Θ®Φ¥ΒΞ≤ψ ·ΡΪΘ©Θ§ΗΟ»ήΫβΩΥΖΰΝΥ ·ΡΪ≤ψ”κ≤ψ÷°ΦδΒΡΘ® Θ©
A.ΖΕΒ¬ΜΣΝΠ
B.άκΉ”Φϋ
C.Ι≤ΦέΦϋ
D.Ϋπ τΦϋ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΩΤΡΩΘΚΗΏ÷–Μ·―ß ά¥‘¥ΘΚ Χβ–ΆΘΚ
ΓΨΧβΡΩΓΩ¥”ΡχΩσ ·Έ≤Ωσ÷–Χα»ΓNiSO4 «ΫβΨωΈ“ΙζΡχΉ ‘¥Ί―ΖΠΒΡ“ΜΧθ÷Ί“ΣΆΨΨΕΘ§“―÷ΣΗΟΙΐ≥Χ»γœ¬ΘΚ
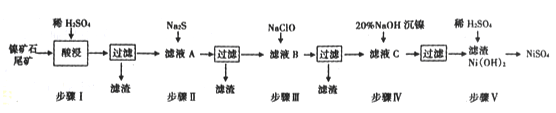
±μ1ΘΚΗςΈο÷ ΒΡKsp ΐΨί»γœ¬±μΘΚ
Έο÷ | MnS | NiS | PbS | CuS | Ni(OH)2 |
Ksp | 2.5ΓΝ10-13 | 1.1ΓΝ10-21 | 8.0ΓΝ10-28 | 6.3ΓΝ10-36 | 2.0ΓΝ10-15 |
±μ2ΘΚ¬Υ“ΚA÷–ΗςΫπ τάκΉ”ΒΡΚ§ΝΩ»γœ¬±μΘΚ
≥…Ζ÷ | Ni2+ | Fe3+ | Fe2+ | Mn2+ | Cu2+ | Pb2+ | Γ≠Γ≠ |
3.80 | 4.80 | x | 0. 20 | 0.15 | <0.001 | Γ≠Γ≠ |
ΗυΨί“‘…œ–≈œΔΘ§ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
(1)≤Ϋ÷ηIΥαΫΰ÷°«Α–ηΫΪΩσ ·ΖέΥιΘ§ΡΩΒΡ «____________ΓΘ
(2)»τ‘”÷ άκΉ”ΒΡ≈®Ε»cΓή1.0ΓΝ10-5mol/LΦ¥Ω…»œΕ®≥ΝΒμΆξ»ΪΘ§‘ρ≤Ϋ÷ηΔρ÷–Β±Pb2+ΓΑ«ΓΚΟ≥ΝΒμΆξ»Ϊ ±Θ§»ή“Κ÷–ΝράκΉ”ΒΡ≈®Ε»c(S2-)=_____________
(3)≥ΘΈ¬œ¬Ϋχ––≤Ϋ÷ηΔσΒΡΡΩΒΡ «ΈΣΝΥ≥ΐ»ΞΧζΚΆΟΧ‘ΣΥΊΘ§“―÷Σ≥ΐΧζ‘ΣΥΊΒΡάκΉ”Ζ¥”Π»γœ¬ΘΚ
2Fe2++ ClO - +5H2O=2Fe( OH)3Γΐ+Cl-+4H+
¥Υ ±Mn2+ΒΡ―θΜ·≤ζΈοΈΣMnO2Θ§–¥≥ω≥ΐΟΧ‘ΣΥΊΒΡάκΉ”ΖΫ≥Χ Ϋ______________ΓΘ
(4)ΈΣ≤βΕ®¬Υ“ΚA÷–Fe2+άκΉ”ΒΡΚ§ΝΩΘ§Θ®ΟΩ…ΐ»ή“Κ÷–Κ§”–ΒΡ―«ΧζάκΉ”ΒΡ÷ ΝΩΘ§“‘g/L±μ ΨΘ©ΟΩ¥Έ“Τ»Γ20.00 mL¥ΐ≤β“ΚΘ§≤Δ”Ο0.02 mol/LΒΡKMnO4»ή“ΚΒΈΕ®Θ§»τ“―÷ΣΤδΥϊάκΉ”Ψυ≤ΜΖ¥”ΠΘ§«“»ΐ¥ΈΒΈΕ®ΤΫΨυœϊΚΡKMnO4»ή“Κ18. 00mLΘ§‘ρxΒΡ÷ΒΈΣ________Θ®ΨΪ»ΖΒΫ–Γ ΐΒψΚσΝΫΈΜΘ©ΓΘ
Θ®5Θ©ΥυΒΟNi(OH)2 «÷Τ‘λΡχο”Βγ≥ΊΒΡ÷Ί“Σ‘≠ΝœΘ§Ρχο”Βγ≥ΊΙΛΉς‘≠άμ»γœ¬ΘΚ
Cd+2NiO(OH) +2H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
‘ρΥφΉ≈Ζ≈ΒγΒΡΫχ––Θ§’ΐΦΪ«χpH______Θ®ΧνΓΑ‘ω¥σΓ±ΓΔΓΑΦθ–ΓΓ±ΜρΓΑ≤Μ±δΓ±Θ©ΘΜ≥δΒγ ±“θΦΪΒγΦΪΖ¥”Π ΫΈΣ______ΓΘ
≤ιΩ¥¥πΑΗΚΆΫβΈω>>
ΑΌΕ»÷¬–≈ - ΝΖœΑ≤αΝ–±μ - ‘ΧβΝ–±μ
Κΰ±± ΓΜΞΝΣΆχΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΤΫΧ® | Άχ…œ”–ΚΠ–≈œΔΨΌ±®Ή®«χ | Βγ–≈’©Τ≠ΨΌ±®Ή®«χ | …φάζ Ζ–ιΈό÷ς“ε”–ΚΠ–≈œΔΨΌ±®Ή®«χ | …φΤσ«÷»®ΨΌ±®Ή®«χ
ΈΞΖ®ΚΆ≤ΜΝΦ–≈œΔΨΌ±®ΒγΜΑΘΚ027-86699610 ΨΌ±®” œδΘΚ58377363@163.com