
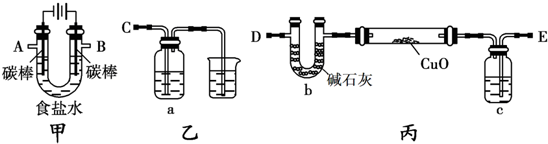
分析 (1)甲装置电解饱和食盐水,左侧碳棒连接电源负极,为阴极,右侧碳棒连接电源正极,为阳极,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大,遇到酚酞溶液变红色;
(2)甲装置中B口导出的气体为氯气,用氢氧化钠溶液吸收氯气,反应生成氯化钠、次氯酸钠与水;
(3)通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率,是利用U形管测定氢气还原氧化铜过程中生成的水蒸气,要防止外界空气中的水蒸气等被U形管中碱石灰吸收,结合氢气还原氧化铜时,氢气不能全部反应来考虑;
(4)根据溶液pH计算氢氧根离子浓度,结合化学方程式计算反应的氯化钠质量,计算200ml溶液中氯化钠的质量,用反应的氯化钠质量除以原溶液中氯化钠质量得到食盐水的电解率.
解答 解:(1)甲装置电解饱和食盐水,左侧碳棒连接电源负极,为阴极,右侧碳棒连接电源正极,为阳极,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大,遇到酚酞溶液变红色,电解氯化钠的总反应为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+2H2↑+2OH-,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+2H2↑+2OH-;左;
(2)甲装置中B口导出的气体为氯气,用氢氧化钠溶液吸收氯气,则装置B连C,反应生成氯化钠、次氯酸钠与水,离子方程式为:Cl2+2OH-=H2O+Cl-+ClO-,
故答案为:B;C;Cl2+2NaOH=H2O+NaCl+NaClO;
(3)利用甲、丙装置测定饱和食盐水的电解率,通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率,是利用U形管测定氢气还原氧化铜过程中生成的水蒸气,装置中添加一干燥装置防止外界空气中的水蒸气的干扰,c中应该盛的试剂是浓硫酸,氢气还原氧化铜时,氢气不能全部反应,所以该方案测得的实验结果不准确,故答案为:浓硫酸;氢气还原氧化铜时,氢气不能全部反应,误差太大;
(4)若电解200mL饱和食盐水一段时间,测得溶液的为pH为14,则c(H+)=10-14mol/L,c(OH-)=1mol/L,氢氧根离子物质的量=0.2L×1mol/L=0.2mol,由2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑可知,电解的氯化钠物质的量为0.2mol,其质量=0.2mol×58.5g/mol=11.7g,$\frac{11.7g}{58.5g}$×100%=20%,
故答案为:20%.
点评 本题考查电解原理应用、定量测定实验、对装置的分析评价等,关键是对实验原理的理解,侧重考查学生对基础知识的迁移应用,题目难度中等.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 255 | 385 | 459 |
| 生成气体体积/mL | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH320ml、NO240ml、N240ml | B. | NH3 20ml、NO32ml、CO248ml | ||
| C. | NH320ml、NO20ml、CO260ml | D. | NH320ml、CO228ml、NO52ml |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的平均分子量不再变化 | B. | 反应的平衡常数不变 | ||
| C. | ?(H2)=2 ?(HI) | D. | 气体的颜色不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 5.6LN2(标准状况)和11gCO2 | B. | 10gH2和10gO2 | ||
| C. | 9gH2O 和0.5molBr2 | D. | 22.4mlH2 (标准状况)和0.1molN2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
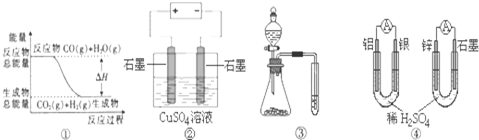
| A. | 图①表示可逆反应“CO(g)+H2O(g)?CO2(g)+H2(g)”中的△H大于0 | |
| B. | 图②为电解硫酸铜溶液的装置,一定时间内,两电极产生单质的物质的量之比一定为1:1 | |
| C. | 图③实验装置可完成比较磷酸、碳酸、苯酚的酸性强弱的实验 | |
| D. | 图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量也相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液能清洗油污:CO32-+2H2O═H2CO3+2OH- | |
| B. | 铜与浓硫酸共热产生气体:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2↑ | |
| C. | 铁钉在潮湿的空气中很快被腐蚀:Fe-3e-═Fe3+ | |
| D. | 氨气遇到氯化氢时产生白烟:NH3+HCl═NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应速率是化学反应进行快慢程度的物理量 | |
| B. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 | |
| C. | 在同一个反应中,可以用反应物或生成物来表示反应速率 | |
| D. | 化学反应速率的常用单位有mol/(L•s)和mol/(L•min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com