
| Ksp |
| c(Fe2+) |
|


科目:高中化学 来源: 题型:
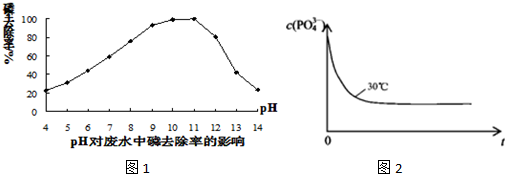
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当周围有人感染埃博拉病毒(EBOV)时,可以吃些抗生素以防被传染 |
| B、上呼吸道感染、咽痛等病毒疾病应该使用抗生素治疗 |
| C、抗生素在治病的同时也有副作用,没有一种抗生素是绝对安全而无副作用的 |
| D、使用某抗生素一两天后病情没有明显好转,应尽快换用其他抗生素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
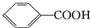 >H2C03>
>H2C03> ,将
,将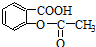 转变为
转变为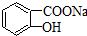 的方法有( )
的方法有( )| A、①② | B、①③ | C、②③ | D、① |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ |
| B、SO42-,Na+ |
| C、S2-,SO42-,Na+ |
| D、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上通过电解MgO制取镁 |
| B、工业上通过向浓缩的海水中通入氯气获得碘 |
| C、工业上主要通过高温冶炼黄铜矿获得铜 |
| D、工业上用二氧化锰与浓盐酸制备氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、移去部分SO3 |
| B、降低体系温度 |
| C、压缩反应容器的体积 |
| D、升高体系温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HF、HCl、HBr、HI的热稳定性依次减弱,沸点却依次升高 |
| B、熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 |
| C、NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
| D、NCl3分子中所有的原子均为8电子稳定结构 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com