
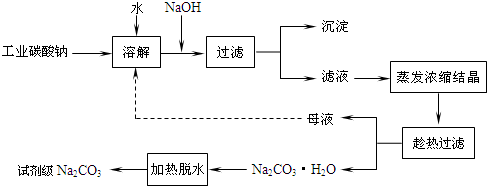
��ҵ̼���ƣ�����ԼΪ98�����к���Ca2+��Mg2+��Fe3+��Cl����SO42�������ʣ��ᴿ������·��ͼ��ʾ��

��̼���Ƶı�����Һ�ڲ�ͬ�¶���������������ͼ��ʾ��

���й����ʵ��ܶȻ�����
|
���� |
CaCO3 |
MgCO3 |
Ca��0H��2 |
Mg��OH��2 |
Fe��OH��3 |
|
Ksp |
4.96��10��9 |
6.82��10��6 |
4.68��10��6 |
5.61��10��12 |
2.64��10��39 |
�ش��������⣺
��1������NaOH��Һʱ����Ӧ�����ӷ���ʽΪ ������Mg2+��Fe3+����Һ�еμ�NaOH��Һ�������ֳ�����������Һ��pH=8ʱ��c��Mg2+����c��Fe3+��= ��
��2����ĸҺ���г��˺���Na+��CO32���⣬������ �����ӡ�
��3�����˴ӡ���ɫ��ѧ���Ƕ����뽫��ĸҺ�������������߽���ѭ��ʹ�á����������ʵ�ʹ�ҵ�������Ƿ���У� ������С������С�������˵�����ɣ� ��
��4����֪��Na2CO3��10H2O��s��=Na2CO3��s��+10H2O��g�� =+532.36 kJ��mol��1
=+532.36 kJ��mol��1
Na2CO3��10H2O��s��=Na2CO3��H2O��s��+9H2O��g��  =+473.63
kJ��mol��1
=+473.63
kJ��mol��1
д��Na2CO3��H2O��ˮ��Ӧ���Ȼ�ѧ����ʽ�� ��
��1��MgCO3+2OH�� =
Mg��OH��2+ CO32������дFe3++3 OH��=Fe��OH��3����Mg2++2 OH��=Mg��OH��2�����÷֣���3�֣�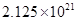 ��3�֣�
��3�֣�
��2��Cl����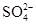 ��2�֣�
��2�֣�
��3�������У�2�֣� ����ĸҺ��ѭ��ʹ�ã�����Һ��c��Cl������c��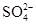 ������������ò���Na2CO3�������ʣ�2�֣�
������������ò���Na2CO3�������ʣ�2�֣�
��4��Na2CO3��H2O��s��=Na2CO3��s��+ H2O��g�� ��H=+58.73 kJ��mol��1 ��3�֣�
��������
������������ܶȻ���֪��MgCO3��Ksp�������Һ���ܽ����࣬����������MgCO3�����������ϴ�����Һ����Ժ��ԡ�
��1����Ҫ��MgCO3��NaOH�ķ�Ӧ����Ksp��С�ij���Mg��OH��2��
PH=8 ��C OH-=10��6 Ksp= c��Mg2+��C 2��OH-��= c��Mg2+��10��12 =5.61��10��12 c��Mg2+��=5.61
Ksp= c��Fe3+��C 3��OH-��=c��Fe3+��10��18=2.64��10��39 c��Fe3+��=2.64��10��21
c��Mg2+����c��Fe3+��=5.61��2.64��10��21=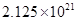
��2��ĸҺ���У���CO32�����γɳ�����ֻ��Cl����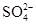
��4����Na2CO3��10H2O��s��=Na2CO3��s��+10H2O��g��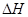 =+532.36 kJ��mol��1
=+532.36 kJ��mol��1
��Na2CO3��10H2O��s��=Na2CO3��H2O��s��+9H2O��g�� 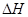 =+473.63
kJ��mol��1
=+473.63
kJ��mol��1
��-�ڵã�Na2CO3��H2O��s��=Na2CO3��s��+ H2O��g�� ��H=+58.73 kJ��mol��1
���㣺���⿼��Ksp���㡢���ӹ��桢��˹���ɵ����֪ʶ��


 ���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д�
���Ŀ��ּ�����ҵ�����ҵ����������ϵ�д� ����ѵ��ϵ�д�
����ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
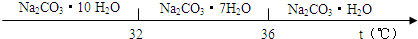
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


| ���� | CaCO3 | MgCO3 | Ca��OH��2 | Mg��OH��2 | Fe ��OH��3 |
| Ksp | 4.96��10-9 | 6.82��10-6 | 4.68��10-6 | 5.61��10-12 | 2.64��10-39 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��10�֣���ҵ̼���ƣ�����ԼΪ98�����г�����Ca2+��Mg2+��Fe3+��Cl����SO42�������ʣ�Ϊ���ᴿ��ҵ̼���ƣ�������Լ���̼���ƵĹ�������ͼ���£�
��֪��̼���Ƶı�����Һ�ڲ�ͬ�¶�����������������ͼ��ʾ��
��1������NaOH��Һʱ���������ӷ�Ӧ����ʽΪ �� �� �� ��
��2���ȵ�Na2CO3��Һ�н�ǿ��ȥ������������ԭ���ǣ������ӷ���ʽ����Ҫ�����ּ��Խ��ͣ� �� ��
��3�������ȹ��ˡ�ʱ���¶�Ӧ������ �� ��
��4����֪��Na2CO3��10H2O(s)��Na2CO3(s)��10 H2O(g) ��H��+532.36kJ��mol��1
��Na2CO3��10H2O(s)��Na2CO3��H2O(s)��9 H2O(g) ��H��+473.63kJ��mol��1
д��Na2CO3��H2O��ˮ��Ӧ���Ȼ�ѧ����ʽ �� ��
��5�����˴ӡ���ɫ��ѧ���Ƕ����뽫��ĸҺ��������ͼ��������ʾ����ѭ��ʹ�á��������ʵ���������Ƿ���� �� ���������� �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ʡ��ͨ��ͨ����2010�������©��ȱר����ϰ��ѧ���� ���ͣ������
��10�֣���ҵ̼���ƣ�����ԼΪ98�����г�����Ca2+��Mg2+��Fe3+��Cl����SO42�������ʣ�Ϊ���ᴿ��ҵ̼���ƣ�������Լ���̼���ƵĹ�������ͼ���£�

��֪��̼���Ƶı�����Һ�ڲ�ͬ�¶�����������������ͼ��ʾ��

��1������NaOH��Һʱ���������ӷ�Ӧ����ʽΪ �� �� �� ��
��2���ȵ�Na2CO3��Һ�н�ǿ��ȥ������������ԭ���ǣ������ӷ���ʽ����Ҫ�����ּ��Խ��ͣ� �� ��
��3�������ȹ��ˡ�ʱ���¶�Ӧ������ �� ��
��4����֪��Na2CO3��10 H2O(s)��Na2CO3(s)��10 H2O(g) ��H��+532.36kJ��mol��1
��Na2CO3��10 H2O(s)��Na2CO3��H2O(s)��9 H2O(g) ��H��+473.63kJ��mol��1
д��Na2CO3��H2O��ˮ��Ӧ���Ȼ�ѧ����ʽ �� ��
��5�����˴ӡ���ɫ��ѧ���Ƕ����뽫��ĸҺ��������ͼ��������ʾ����ѭ��ʹ�á��������ʵ���������Ƿ���� �� ���������� �� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com