
【题目】氨是最重要的氮肥,是产量最大的化工产品之一。其合成原理为:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,
2NH3(g) ΔH=-92.4 kJ·mol-1,
I. 该反应 N2(g)+3H2(g)![]() 2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。
2NH3(g)△H=﹣92.4kJ/mol 在一密闭容器中发生,下图是某一时间段反应速率与反应进程的关系曲线图。

(1)t1、t3、t4时刻,体系中分别是什么条件发生了变化?
t1___________,t3____________,t4__________。
(2)下列时间段中,氨的百分含量最高的是__________
A.0~t1 B.t2~t3
C.t3~t4 D.t4~t5
II. 在密闭容器中,投入1mol N2和3 mol H2在催化剂作用下发生反应:
(1)当反应达到平衡时,N2和H2的浓度比是___________;N2和H2的转化率比是___________。
(2)缩小体积增大压强,混合气体的平均相对分子质量________ (填“变大”、“变小”或“不变”)。
(3)当达到平衡时,充入氩气,并保持总压强不变,平衡将___________(填“正向”、“逆向”或“不移动”)。
(4)已知合成氨的反应在298K时:正反应的△H=-92.4kJ/mol,△S=-0.1982kJ/(mol·K),根据焓变和熵变判断298K下合成氨反应________(填“能”或“不能”)自发进行。
(5)若容器恒容、绝热,该反应达到平衡的标志是___________
①反应速率v(N2):v(H2):v(NH3)=1:3:2
②各组分的物质的量浓度不再改变
③体系的压强不再发生变化
④混合气体的密度不变
⑤体系的温度不再发生变化
⑥2V正(N2) =V正(NH3)
⑦单位时间内3mol H-H断裂同时2mol N-H也断裂.
【答案】升温加入催化剂减压A1∶31∶1变大逆向能②③⑤
【解析】
由N2(g)+3H2(g)2NH3(g)ΔH=-92.4 kJ·mol-1,可知,该反应为放热反应,且为气体体积减小的反应。
I.(1)由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;t3正逆反应速率同等程度的增大,改变条件应为使用催化剂;t4时正逆反应速率均减小,且逆反应速率大于正反应速率,改变条件应为减小压强,故答案为:升高温度;加入催化剂;减压
(2)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大,故答案为:A;
II.(1) N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始(mol) 1 3 0
反应(mol) x 3x 2x
平衡(mol)1-x 3-3x 2x
当反应达到平衡时,N2和H2的浓度之比等于物质的量之比=![]() =
=![]() ;N2和H2的转化率比=
;N2和H2的转化率比=![]() :
:![]() =
=![]() ,故答案为:
,故答案为:![]() ;
;![]() ;
;
(2)缩小体积增大压强,平衡正向移动,气体的物质的量减小,但质量不变,因此混合气体的平均相对分子质量变大,故答案为:变大;
(3)当达到平衡时,充入氩气,并保持总压强不变,体积增大,相当于减小压强,平衡逆向移动,故答案为:逆向;
(4)298K时:合成氨的正反应的△H=-92.4kJ/mol,△S=-0.1982kJ/(mol·K),根据△G=△H-T△S=(-92.4kJ/mol)-298K×[-0.1982kJ/(mol·K)]=-33.34<0时,反应能自发进行,故答案为:能;
(5)①任何时候都满足反应速率v(N2):v(H2):v(NH3)=1:3:2,不能判断是否达到平衡状态,错误;②各组分的物质的量浓度不再改变,是达到和谐平衡的标志,正确;③容器恒容、绝热,该反应为气体物质的量减少的反应,说明气体的物质的量为变量,即体系的压强为变量,因此压强不再发生变化,能够说明达到平衡状态,正确;④容器的体积和气体的质量均不变,混合气体的密度始终不变,不能判断是否达到平衡状态,错误;⑤容器恒容、绝热,该反应为放热反应,容器中气体的温度是变量,因此体系的温度不再发生变化,能够说明达到平衡状态,正确;⑥2V正(N2) =V正(NH3) 不能说明正、逆反应速率的关系,因此不能判断是否达到平衡状态,错误;⑦根据N2(g)+3H2(g)![]() 2NH3(g),单位时间内3mol H-H断裂同时有2mol N-H断裂,表示正反应速率大于逆反应速率,不是平衡状态,错误;故答案为:②③⑤。
2NH3(g),单位时间内3mol H-H断裂同时有2mol N-H断裂,表示正反应速率大于逆反应速率,不是平衡状态,错误;故答案为:②③⑤。


科目:高中化学 来源: 题型:
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法错误的是
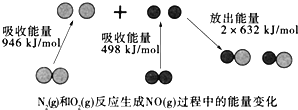
A. 该反应的热化学方程式为:N2(g)+O2(g)═2NO(g)△H=+180kJ·mol﹣1
B. 1mol N2(l)和NA个O2(l)反应生成2mol NO(g)时,吸收的能量为180kJ
C. 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D. 通常情况下,N2(g)和O2(g)混合不能直接生成NO(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,其放电时的原电池反应:![]() 根据此反应判断,下列叙述中正确的是
根据此反应判断,下列叙述中正确的是![]()
![]()
A. Pb是正极
B. ![]() 得电子,被氧化
得电子,被氧化
C. 电池放电时,溶液的酸性增强
D. 负极反应是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】32g铜与150mL一定浓度的硝酸恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L.请回答:(不要求写计算过程)
(1)写出铜与稀硝酸反应的化学方程式________________。
(2)NO为_________ mol.标准状况V(NO):V(NO2)=________
(3)原硝酸溶液的浓度为__________ molL-1 。
(4)试描述实验过程中试管内产生气体现象___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于反应:①2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) △H=﹣2600 kJ/mol
4CO2(g)+2H2O(l) △H=﹣2600 kJ/mol
②2CO(g)+O2(g)![]() 2CO2(g) △H=﹣566 kJ/mol
2CO2(g) △H=﹣566 kJ/mol
③CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=﹣49.0 kJ/mol
CH3OH(g)+H2O(g) △H=﹣49.0 kJ/mol
下列叙述正确的是
A. 根据方程式②,CO的燃烧热为566 kJ/mol
B. 在③反应时,若加入催化剂,可以使△H减小
C. 若投入1molCO2和3molH2在一定条件下充分反应,则放出热量49.0 kJ
D. 若生成相同质量的CO2,则放出的热量C2H2大于CO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法正确的是
A.苯、氯乙烯、丙烯分子中所有原子均在同一平面
B.汽油、柴油、植物油都是碳氢化合物
C.甲烷、乙烷、丙烷在光照下分别与氯气反应,生成的一氯代物都只有一种
D.乙醇、甲苯和溴苯可用水鉴别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯环结构中,不存在单、双键交替结构,下列可以作为证据的事实是( )
![]() 苯不能使酸性高锰酸钾溶液褪色
苯不能使酸性高锰酸钾溶液褪色
![]() 苯中所有碳碳键的键长均相等
苯中所有碳碳键的键长均相等
![]() 苯与氢气在催化剂存在的条件下加热能发生加成反应生成环己烷
苯与氢气在催化剂存在的条件下加热能发生加成反应生成环己烷
![]() 经实验测得邻二甲苯只有一种结构
经实验测得邻二甲苯只有一种结构
![]() 苯在溴化铁存在的条件下与液溴发生取代反应,但不能因化学变化而使溴水褪色
苯在溴化铁存在的条件下与液溴发生取代反应,但不能因化学变化而使溴水褪色
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积固定为a L的密闭容器中充入1 mol X气体和2 mol Y气体,发生反应X(g)+2Y(g) ![]() 2Z(g),此反应达到平衡状态的标志是( )
2Z(g),此反应达到平衡状态的标志是( )
A. 容器内气体密度不随时间变化 B. 容器内各物质的浓度不随时间变化
C. 容器内X、Y、Z的浓度之比为1∶2∶2 D. 单位时间内消耗0.1 mol X,同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2H2(g)+ O2(g) = 2H2O(g),H—H、O=O和O—H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则2mol H2完全燃烧放出的热量为
A. 480 kJ B. 916 kJ C. 960 kJ D. 190 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com