过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途.
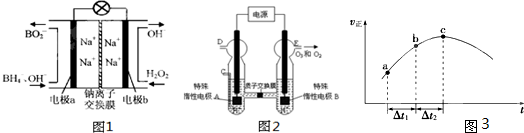
(1)据报道以硼氢化合物NaBH
4(B的化合价为+3价)和H
2O
2作原料的燃料电池,可用作通信卫星电源.负极材料采用Pt/C,正极材料采用MnO
2,其工作原理如图1所示.该电池放电时正极的电极反应式为:
H2O2+2e-=2OH-
H2O2+2e-=2OH-
;以MnO
2做正极材料,可能是因为
MnO2对电极反应具有催化作用
MnO2对电极反应具有催化作用
.
(2)火箭发射常以液态肼(N
2H
4)为燃料,液态过氧化氢为助燃剂.
已知:N
2H
4(g)+O
2(g)=N
2(g)+2H
2O(g)△H=-534kJ?mol
-1H
2O
2(l)=H
2O(l)+1/2O
2(g)△H=-98.64kJ?mol
-1H
2O(l)=H
2O(g)△H=+44kJ?mol
-1反应N
2H
4(g)+2H
2O
2(l)=N
2(g)+4H
2O(g) 的△H=
-643.28kJ?mol-1
-643.28kJ?mol-1
.
(3)O
3可由臭氧发生器(原理如图2所示)电解稀硫酸制得.
①图中阴极为
A
A
(填“A”或“B”).
②若C处通入O
2,则A极的电极反应式为:
O2+4H++4e-=2H2O
O2+4H++4e-=2H2O
.
③若C处不通入O
2,D、E处分别收集到11.2L和有4.48L气体(标准状况下),则E处收集的气体中O
3所占的体积分数为
50%
50%
(忽略O
3的分解).
(4)新型O
3氧化技术对燃煤烟气中的NOx和SO
2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O
3 (g)
NO
2(g)+O
2(g).在一定条件下,将NO和O
3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图(如图3)所示.由图可得出的正确说法是
d
d
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.反应物的总能量低于生成物的总能量
d.△t
1=△t
2时,NO的转化率:a~b段小于b~c段.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案

