
【题目】下面是元素周期表的草图,表中所列字母代号分别代表某一种元素,请回答:

(1)表中最活泼的金属与最活泼的非金属形成的物质是___(填化学式)。
(2)由a、d两种元素可形成两种化合物,这两种化合物中都含的化学键有__(填字母)。
a.极性共价键 b.非极性共价键 c.离子键
(3)e、f、k、m对应的离子的半径由小到大的顺序为:___。
(4)d、e、m的最简单气态氢化物的稳定性由强到弱的顺序为:__。
(5)由m、n两种元素组成的常见化合物的电子式为:__。
(6)用电子式表示a与d形成的原子个数比1∶1的化合物的形成过程:___。
【答案】KF a Al3+、Na+、F-、S2- HF、H2O、H2S ![]()
![]()
【解析】
依据元素所在周期表的位置,可确定a为H、b为C、d为O、e为F、f为Na、k为Al、m为S、n为K、p为Br。同周期元素,从左往右,原子半径依次减小,金属性依次减弱,非金属性依次增强;同主族元素,从上到下,原子半径依次增大,金属性依次增强,非金属性依次减弱。金属性越强,与酸或水反应越剧烈,最高价氧化物的水化物的碱性越强;非金属性越强,氢化物越稳定,最高价氧化物的水化物的酸性越强。
(1)表中最活泼的金属为K,最活泼的非金属为F,二者形成的物质是KF。答案为:KF;
(2)由a、d两种元素可形成两种化合物H2O和H2O2,前者只含极性键,后者含极性键和非极性键,所以这两种化合物中都含有的化学键为极性共价键,故选a。答案为:a;
(3)e、f、k、m对应的离子分别为F-、Na+、Al3+、S2-,F-、Na+、Al3+的电子层数相同,S2-比F-、Na+、Al3+多一层,离子半径最大。电子层数相同的离子,核电荷数越小,离子半径越大,所以半径由小到大的顺序为:Al3+、Na+、F-、S2-。答案为:Al3+、Na+、F-、S2-;
(4)d、e、m的最简单气态氢化物分别为HF、H2O、H2S,非金属性越强,氢化物越稳定,所以稳定性由强到弱的顺序为:HF、H2O、H2S。答案为:HF、H2O、H2S;
(5)m、n两种元素分别为S、K,二者组成的常见化合物为K2S,电子式为![]() 。答案为:
。答案为:![]() ;
;
(6)a与d形成的原子个数比1∶1的化合物为H2O2,用电子式表示的形成过程为![]() 。答案为:
。答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】室温下,下列指定溶液中微粒的浓度关系正确的是( )
A. ![]() 溶液中:
溶液中:![]()
B. ![]() 溶液中:
溶液中:![]()
C. ![]() 弱酸
弱酸![]() 与
与![]() 溶液等体积混合的溶液中:
溶液等体积混合的溶液中: ![]()
D. ![]() 溶液与同浓度等体积盐酸混合的溶液中:
溶液与同浓度等体积盐酸混合的溶液中:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表所列的是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(1)比较A、B、E三种元素的简单离子的离子半径大小___(用对应元素离子符号表示)。
(2)A元素简单离子的结构示意图为__,B元素位于周期表中第__周期__族。
(3)B的最高价氧化物对应水化物与C的最高价氧化物对应水化物反应的离子方程式为__。
(4)上述五种元素的最高价氧化物对应水化物中酸性最强的是__(填化学式)。
(5)C、E形成的化合物为__(填化学式)。
(6)用电子式表示A和D形成化合物的过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,探究铜与稀HNO3的反应过程如图:
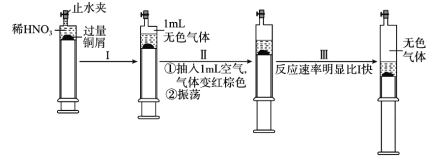
下列说法不正确的是( )
A.过程I中生成无色气体的离子方程式是3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
B.步骤III反应速率比I快的原因是NO2溶于水,使c(HNO3)增大
C.由实验可知,NO2对该反应具有催化作用
D.当活塞不再移动时,打开止水夹,滴加稀硫酸,铜可以继续溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图均能表示甲烷的分子结构,按要求回答下列问题:
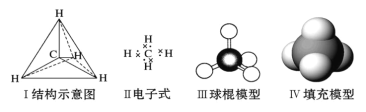
(1)下列事实能证明甲烷分子是正四面体结构,而不是平面结构的证据是___。
a.CH3Cl只有一种结构
b.CH2Cl2只有一种结构
c.CHCl3只有一种结构
d.CCl4只有一种结构
(2)1molCH4含__mol共用电子对,1mol某烷烃(CnH2n+2)含有__mol共用电子对。
(3)![]() 中共面的原子最多有__个。
中共面的原子最多有__个。
(4)某烷烃相对分子质量为58,其二氯代物有__种。
(5)若CH4、C2H6、C3H8、C4H10四种烃各为1g,在足量O2中燃烧,消耗O2最多的是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁香油酚的结构简式如图所示,从它的结构简式可推测它不可能有的化学性质是 ( )
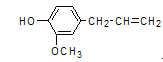
A. 既可燃烧,也可使酸性KMnO4溶液褪色
B. 可与NaHCO3溶液反应放出CO2气体
C. 可与FeCl3溶液发生显色反应
D. 既可与Br2发生加成反应又可发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制备乙酸乙酯的绿色合成路线之一为:
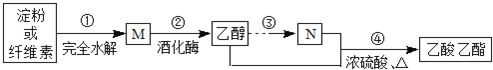
下列说法正确的是( )
A.淀粉与纤维素互为同分异构体
B.M的分子式为C12H22O11
C.N的结构简式为C2H4O2
D.④的反应类型属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组经查阅资料得知常温下过量的氨气和氯气能反应生成氯化铵,该实验小组对该反应进行探究,部分实验装置如下(夹持装置略去)
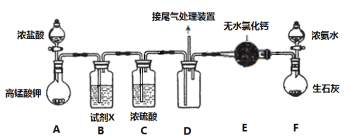
回答下列问题
(1)装置F是NH3的制备装置,其中盛放浓氨水的仪器名称是___________,再写出一种在实验室制备NH3的反应原理(用化学方程式表示)____________。
(2)某同学认为应将E中的无水氯化钙换成碱石灰,他的理由______________。
(3)装置A中发生反应的离子方程式为___________。
(4)装置B中盛装的试剂X的名称为_________,该装置的作用为__________。
(5)装置D的设计中有明显不足之处,请提出改进意见______________。
(6)某同学设计实验证明装置D中所得固体为氯化铵,请把实验步骤写完整:
①取少量装置D中所得固体产物配成溶液,并取少量溶液于两支试管中;
②__________________________;
③向另一只试管中加过量稀硝酸,再加AgNO3溶液,有白色沉淀生成,结论:常温下过量的氨气和氯气反应可生成氯化铵。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外研究性学习小组用下图所示装置制备少量溴苯并验证溴与苯的反应是取代反应。
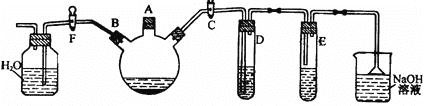
实验时,关闭F活塞,打开C活塞,在装有少量苯的三口烧瓶中由A口加入少量液溴,再加入少量铁屑,塞住A口。回答下列问题:
(1)三口烧瓶中发生的化学反应方程式为_______。
(2)D试管内装的是CCl4溶液,其作用是_______。
(3)除去溴苯中混有的Br2杂质的试剂是______,操作方法为:___,有关化学方程式________。
(4)反应完毕后,试管E(AgNO3溶液)中有___(填现象)生成,说明这种获得溴苯的反应属于_______反应。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com