
【题目】镍钴锰三元材料是近年来开发的一类新型锂离子电池正极材料,具有容量高、循环稳定性好、成本适中等重要优点。镍钴锰三元材料中Ni为主要活泼元素,通常可以表示为:LiNiaCobMncO2,其中a+b+c=1,可简写为LiAO2。充电时总反应为LiAO2 + nC = Li1-xAO2 + LixCn(0<x<1),工作原理如下图所示,则以下说法正确的是( )

A. 放电时Ni元素最先失去电子
B. 放电时电子从a电极由导线移向b电极
C. 充电时的阳极反应式为LiAO2 - xe-= Li1-xAO2 + xLi+
D. 充电时转移1mol电子,理论上阴极材料质量增加7g
 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】在某一温度下,某一密闭容器中,M、N、R三种气体浓度的变化如图a所示,若其它条件不变,当温度分别为T1和T2时,N的体积分数与时间关系如图b所示.则下列结论正确的是( )

A.该反应的热化学方程式![]() △H>0
△H>0
B.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
C.达到平衡后,若其它条件不变,升高温度,正、逆反应速度均增大,M的转化率减小
D.达到平衡后,若其他条件不变,通入稀有气体,平衡一定向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,被科学家们高度评价为“稻草变黄金”。下列有关说法中,你认为错误的是( )
A. Na的还原性强于金刚石B. 另一种化合物是NaCl
C. 纳米级金刚石粉末可以透过半透膜D. 这个反应是置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题)
(一)近年来化学家研究开发出用乙烯和乙酸为原料、杂多酸作催化剂合成乙酸乙酯的新工艺,不必生产乙醇或乙醛做中间体,使产品成本降低,具有明显经济优势。其合成的基本反应如下:
CH2=CH2(g)+CH3COOH(1)![]() CH3COOC2H5(1)
CH3COOC2H5(1)
(1)下列描述能说明固定容器中乙烯与乙酸合成乙酸乙酯的反应已达化学平衡的是___________。
A.乙酸、乙酸乙酯的浓度相同
B.酯化合成反应的速率与酯分解反应的速率相等
C.体系中气体密度一定
D.乙烯断开1mol碳碳双键的同时乙酸恰好消耗1mol
(2)在n(乙烯)与n(乙酸)物料比为1的条件下,某研究小组在不同压强下进行了在相同时间点乙酸乙酯的产率随温度的变化的测定实验,实验结果如图所示。回答下列问题:
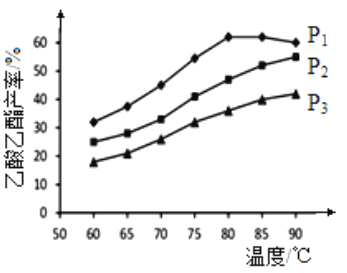
①温度在60~90℃范围内,乙烯与乙酸酯化合成反应速率由大到小的顺序是___________[用v(P1)、v(P2)、v(P3)分别表示不同压强下的反应速率],分析其原因为______________________。
②在压强为P1MPa、温度超过80℃时,乙酸乙酯产率下降的原因可能是______________________。
③根据测定实验结果分析,较适宜的生产条件是______________________(填出合适的压强和温度)。为提高乙酸乙酯的产量和纯度,可以采取的措施有______________________(任写出一条)。
(3)已知反应③的标准平衡常数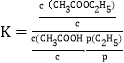 ,其中cΘ为标准浓度(1.0mol/L),p(C2H4)为平衡系统中C2H4的平衡分压,p(C2H4)=p总x(C2H4),x(C2H4)为平衡系统中C2H4的体积分数,pΘ为标准压强(1.0×105Pa)。若等物质的量的乙烯和乙酸在80℃和10MPa下反应,乙酸乙酯的平衡产率为80%,则KΘ=__________。
,其中cΘ为标准浓度(1.0mol/L),p(C2H4)为平衡系统中C2H4的平衡分压,p(C2H4)=p总x(C2H4),x(C2H4)为平衡系统中C2H4的体积分数,pΘ为标准压强(1.0×105Pa)。若等物质的量的乙烯和乙酸在80℃和10MPa下反应,乙酸乙酯的平衡产率为80%,则KΘ=__________。
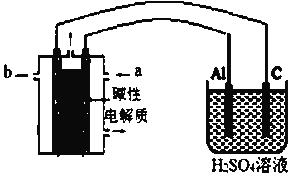
(二)某化学兴趣小组在实验室中模拟铝制品表面“钝化”处理过程(装置如图所示)。可供选择的试剂有:甲醇,空气,KOH溶液,其中物质b是__________,铝电极的电极反应为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(加试题 )M结构简式如图所示,是牙科粘合剂,X是高分子金属离子螯合剂,以下是两种物质的合成路线:


已知:I.A为烯烃,C属于环氧类物质,G分子中只有1种氢原子
II.
III.
IV.R1CHO+R2NH2![]() R1CH=NH2+H2O
R1CH=NH2+H2O
(1)A→B的反应类型是_________,C→D的可采用的反应条件是____________。
(2)下列说法正确的是______。
A.B中含有的官能团是碳碳双键和氯原子
B.J可与Na2CO3溶液反应,1 mol J与饱和溴水反应最多消耗4mol Br2
C.在一定条件下,F可以发生缩聚反应
D.X可发生加成、氧化和消去反应
(3)Q+Y→X的化学方程式是_________________________________________。
(4)请设计以甲苯和A作为原料制备 的合成路线流程图(无机试剂任用)____________________________。
的合成路线流程图(无机试剂任用)____________________________。
(5)写出符合下列条件的K的同分异构体:____________________________
①能发生银镜反应,不能发生水解反应;
②含有五元碳环,核磁共振氢谱有5组峰;
③结构中无-C=C-OH和-O-O-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的微粒浓度关系不正确的是
A. pH=8.3的某酸式盐NaHB的水溶液中:c (Na+) > c (HB-) > c (H2B) > c (B2-)
B. 等物质的量浓度的Na2S和NaHS溶液中:c (Na+)=2c (S2-) + c (HS-)
C. NH4HSO4溶液中滴加NaOH溶液至恰好呈中性:c (Na+) > c (SO42-) > c (NH4+) > c (OH-)=c (H+)
D. 0.1 mol / L NaH2PO4溶液中:c (Na+)=c (PO43-) + c (HPO42-) + c (H2PO4-) + c (H3PO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬是硬度最高的金属,常用于制造不锈钢和仪器仪表的金属表面镀铬,可用铬铁矿(主要成分为FeCr2O4,含有SiO2、Al2O3等杂质)冶炼金属铬。回答下列问题:
I.焦炭冶炼法。反应的化学方程式为FeCr2O4+4C![]() Fe+2Cr+4CO ,该方法的优点是过程简单,主要缺点是___。
Fe+2Cr+4CO ,该方法的优点是过程简单,主要缺点是___。
Ⅱ.铝热冶炼法。冶炼流程如下:
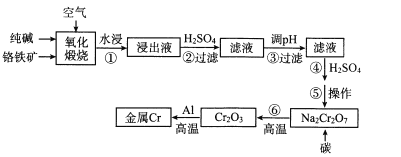
已知:4FeCr2O4+8Na2CO3 +7O2![]() 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
(1)步骤①所得浸出液中的阴离子除CrO42-、CO32-、OH-外,还有____(忽略水解,填化学式)。
(2)步骤③需将pH调____(填“大”或“小”)。
(3)步骤④反应的离子方程式为____。若加H2SO4前c(CrO42-) =0. 020 mol/L,将溶液pH调至3时CrO42-浓度降为1.0×10-5 mol/L(加入H2SO4引起的体积变化可忽略),则该反应的平衡常数为____
(4)相关物质的溶解度曲线如图。步骤⑤需先得到较纯的 Na2Cr2O7·2H2O晶体,其操作方法是____。

(5)步骤⑥除生成Cr2O3外,还生成了Na2CO3和CO,该反应中氧化剂与还原剂的物质的量之比为 ___。可改用Na2 CrO4和Na2S反应得到Cr(OH)3,再热分 解得到Cr2O3。请配平下列化学方程式:___Na2CrO4+___Na2S+___H2O =___Cr(OH)3+___Na2 S2O3+___NaOH___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个绝热定容的密闭容器中,1molA 与 2molB 发生反应 A(g)+2B(g) ![]() xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
xC(g)+2D(g) △H=bkJ·mol1(b<0),下列说法正确的是
A. 充分反应后,放出热量为 b kJ
B. 若 x=1,容器中压强不变时不能判断反应达到平衡
C. 当 B 和 D 的物质的量为 1:1 时,表明该反应已达到平衡
D. 达到平衡过程中,正反应速率可能是先增大再减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com