
【题目】氯化亚铜(CuCl)在有机合成工业中常作催化剂。它是一种白色固体,微溶于水,易被空气中的氧气氧化。某研究性学习小组先在HCl气流中微热分解CuCl2·2H2O制无水CuCl2,再加热制备CuCl,并用下图所示装置进行相关实验探究(夹持仪器略)。
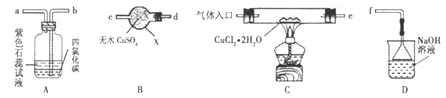
请回答下列问题:
(1)仪器X的名称是_________,装置连接顺序是 接_____、_____接_____、_____接f。
(2)实验操作的先后顺序是①→_____→_____→_____→⑤(填操作的编号)。
①检查装置的气密性后加入药品 ②熄灭酒精灯,冷却 ③在“气体入口”处通入干燥HCl
④点燃酒精灯,加热 ⑤停止通入HCl,然后通入N2其中通入N2气体的目的是________。
(3)在实验过程中,观察到B中物质由白色变为蓝色,A中上层溶液的颜色变化是______,下层CCl4的作用是①吸收少量Cl2;②________。
(4)装置D中发生的氧化还原反应的离子方程式为________。
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuO杂质,则产生的原因___________。
【答案】干燥管dcba③④②让氯化亚铜在氮气流中冷却,防止氯化亚铜被氧化先变红,后褪色防止发生倒吸Cl2+2OH-=Cl-+ClO-+H2O通入HCl的量不足
【解析】
分析:(1)根据仪器X的结构特点回答;(2)本题主要考查盐的水解,加热分解CuCl2·2H2O制无水CuCl2,为防止被氧气氧化及Cu2+水解,必须先通入氯化氢气体把空气赶出。(3)本小题主要考查物质水、氯气等物质的检验。氯气难溶于四氯化碳,可以防止氯化氢气体溶于水发生倒吸;(4)本小题主要考查氯气的尾气处理,D中是Cl2和NaOH反应生成氯化钠、次氯酸钠和水;
本小题主要考查盐的水解,杂质是氧化铜,说明CuCl2水解生成Cu2(OH)2Cl2,进一步分解生成CuO;
解答:(1). X是干燥管;B中物质检验水生成,A中物质检验产物中还有Cl2生成,D尾气处理,装置连接顺序是 e接d、c接b、a接f;(2)为防止被氧气氧化及Cu2+水解,必须先通入氯化氢气体把空气赶出,且在氯化氢气流中加热,反应结束后要先停止加热,再在氮气的氛围中冷却后停止通氮气。实验操作的先后顺序是①检查装置的气密性后加入药品→③在“气体入口” 处通入干燥HCl→④点燃酒精灯,加热→②熄灭酒精灯,冷却→⑤停止通入HCl,然后通入N2;通入N2气体的目的是让氯化亚铜在氮气流中冷却,防止氯化亚铜被氧化 ;(3)在实验过程中有氯气生成, A中上层石蕊溶液的颜色变化是先逐渐变为红色再褪色,下层CCl4的作用是①吸收少量Cl2;②防倒吸。
(4)D中是Cl2和NaOH反应生成氯化钠、次氯酸钠和水,反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O。
(5)杂质是氧化铜,说明CuCl2水解生成Cu2(OH)2Cl2,进一步分解生成CuO,原因是通入HCl的量不足,答案为:通入HCl的量不足;


科目:高中化学 来源: 题型:
【题目】右图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
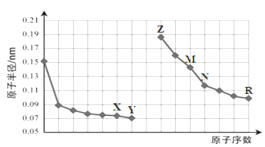
A. X与M形成的一个阴离子中含有29个电子
B. 气态氢化物沸点Y>R
C. 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. Z单质能从M与R元素构成的盐溶液中置换出单质M
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,德国科学家利用数亿个镍原子(28Ni)对数亿个铅原子(82Pb)连续轰击数天后,制得一种新原子![]() (暂用X表示),它属于一种新元素——第110号元素,这种新元素是有史以来制得的最重的元素,存在时间不到千分之一秒,经分析它属于过渡元素,下列关于该元素的叙述中正确的是( )
(暂用X表示),它属于一种新元素——第110号元素,这种新元素是有史以来制得的最重的元素,存在时间不到千分之一秒,经分析它属于过渡元素,下列关于该元素的叙述中正确的是( )
A. 这种原子(![]() )的中子数为169
)的中子数为169
B. 这种元素肯定是金属元素
C. 这种元素属于第6周期元素
D. 这种元素与铅(82Pb)同族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,有可逆反应: 2NO(g)+O2(g)![]() 2NO2(g) △H﹤0,其中NO为无色气体,NO2为红棕色气体。下列不能说明反应已达到平衡状态的是
2NO2(g) △H﹤0,其中NO为无色气体,NO2为红棕色气体。下列不能说明反应已达到平衡状态的是
A. v(NO2) = v(O2) B. 反应器中的压强不随时间变化而变化
C. 混合气体的颜色保持不变 D. 混合气体的平均相对分子质量保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol的镁、铝混合物溶于100 mL 2mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液。请回答:
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如下图所示。
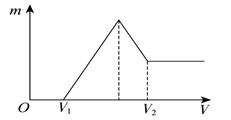
当V1=160mL时,则金属粉末中n(Mg)=________ mol,V2=_____________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH) _____________mL。
(3)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时某些弱酸的电离平衡常数如下表所示:
CH3COOH | HClO | H2CO3 |
K(CH3COOH) =1.8×10-5 | K(HClO) =3.0×10-8 | K(H2CO3)a1=4.4×10-7 K(H2CO3)a2=4.7×10-11 |
常温下,稀释CH3COOH、HClO两种酸时,溶液的pH随加水量变化的曲线如图所示,下列说法正确的是( )
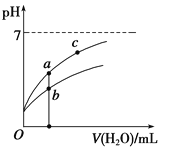
A.相同浓度的CH3COOH和HClO的混合溶液中,各离子浓度的大小关系是:
c(H+)>c(ClO-)>c(CH3COO-)>c(OH-)
B.图像中a、c两点所处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
C.图像中a点酸的浓度大于b点酸的浓度
D.向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O=2HClO+CO32—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式不正确的是
A. 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O
B. 在燃煤中加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2
C. 自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4
D. 在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com