
下列关于“中和反应反应热的测定”实验描述,正确的是
A.实验过程中,用环形铜棒搅拌,使溶液充分混合
B.为了操作方便,可将0.11gNaOH固体迅速投入50mL0.50mol/L的盐酸中进行反应
C.用量筒量取50.0mL盐酸时,俯视刻度导导致所取盐酸体积偏大
D.为了反应充分进行,使用50mL0.50mol/L的盐酸和50mL0.55mol/L的NaOH溶液反应
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届宁夏高三上学期统练二化学试卷(解析版) 题型:填空题
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
(1) 实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率等于____________。
(2) 实验②中,该反应的平衡常数K=____________。
(3) 实验③中,达到平衡时,X的转化率为____________。
(4) 实验④中,达到平衡时,b____________0.060 (填大于、小于、等于)
(5) 实验③中,达到平衡时,a等于 ____________。
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
为了除去CuCl2酸性溶液中的Fe3+,可在加热条件下加入一种试剂,该试剂是
A.氢氧化钠 B.硫酸 C.氧化铜 D.氨水
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:填空题
硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g) 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度℃ | 450 | 475 | 500 | 525 | 550 | 575 | 600 | 650 |
SO2的转化率% | 97.5 | 95.8 | 95.8 | 93.5 | 90.50 | 85.6 | 80.0 | 73.7 |
(1)能判断该反应是否达到平衡状态的是
A.容器的压强不变
B.混合气体的密度不变
C.混合气体中SO3的浓度不变
D.C(SO2)=C(SO3)
E.v正(SO2)=v正(SO3)
F.v正(SO3)=2v逆(O2)
(2)某温度下经2min反应达到平衡后C(SO2)=0.08mol·L-1,
①此时的温度为 ℃
②若将平衡反应混合物的压强增大1倍(假如体积可变),此时Qc为 (可用分数表示),平衡将 向移动。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
在一个容积为VL的密闭容器中放入2molA(g)和1molB(g),在一定条件下发生下列反应:3A(g)+B(g) nC(g)+2D(g),达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
nC(g)+2D(g),达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是
A.1 B.2 C.3 D.4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高二上期中化学试卷(解析版) 题型:选择题
用酸滴定碱时,滴定前读酸式滴定管读数时视线低于水平线,滴定结束时读数正确,这样会使测得的碱溶液的浓度
A.偏高 B.偏低 C.不受影响 D.不能确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上半期考试化学卷(解析版) 题型:选择题
下列关于晶体的说法正确的组合是 ( )
①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
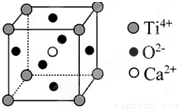
⑤CaTiO3晶体中(晶胞结构如图所示),已知Ca2+、O2—、Ti4+分别位于立方体的体心、面心和顶点,则每个Ti4+和12个O2—相紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④ C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上11月考试化学卷(解析版) 题型:选择题
已知: ①2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol;
②Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ/mol
O2(g) ΔH=-226 kJ/mol
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的燃烧热为 283 kJ
B.反应①正反应活化能与逆反应活化能之差为+566 kJ/mol
C.反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 6.02×1023
查看答案和解析>>
科目:高中化学 来源:2017届山东省东营市高三上期中化学卷(解析版) 题型:选择题
将几滴KSCN(SCN-是“类似卤离子”)溶液加入到酸性的含有Fe3+的溶液中,溶液变为红色,将该红色溶液分为两份:①向其中一份中加入适量KMnO4溶液,红色褪去;②向另一份中通入SO2,红色也褪去。下列说法中不正确的是( )
A.①中红色褪去的原因是KMnO4将SCN-氧化
B.②中红色褪色的原因是SO2将Fe3+还原为Fe2+
C.②中红色褪色的原因是SO2将SCN-还原
D.SCN-在适当条件下可失去电子被氧化剂氧化为(SCN)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com