
| A. | 只用酸性KMnO4溶液 | B. | 只用溴水 | ||
| C. | 只用NaOH溶液 | D. | 用酸性KMnO4溶液和溴水 |
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溴苯中混有溴,加入氢氧化钠溶液后分液 | |
| B. | 苯中混有苯酚,加浓溴水后过滤 | |
| C. | 乙烷中混有乙烯,通过盛有酸性KMnO4溶液的洗气瓶洗气 | |
| D. | 乙酸乙酯中混有乙酸,可选用饱和Na2CO3溶液洗涤,然后将两层液体分开 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
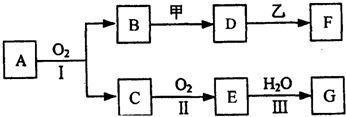
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验目的 | 实验操作 | |
| A. | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| B. | 检验淀粉水解产物的还原性 | 取少量淀粉溶液,与稀硫酸共热后再加入银氨溶液,水浴加热,观察是否出现银镜 |
| C. | 除去乙酸乙酯中混有的少量乙酸 | 加入足量饱和NaHCO3溶液,振荡,静置,分液,取出上层液体 |
| D. | 检验溴乙烷中的溴元素 | 取少量溴乙烷,与氢氧化钠溶液共热后加入硝酸银溶液,观察是否出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙氨酸与苯丙氨酸脱水,最多可以生成3种二肽 | |
| B. | 对苯二甲酸(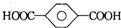 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维( 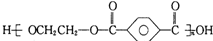 ) ) | |
| C. | 迷迭香酸的结构为 它可以发生酯化、水解、加成、取代、氧化等反应 它可以发生酯化、水解、加成、取代、氧化等反应 | |
| D. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知C-C键可以绕键轴自由旋转,结构简式为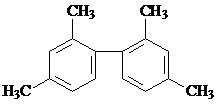 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| B. | 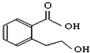 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 能发生的反应类型有:加成反应、取代反应、消去反应、酯化反应、水解反应 | |
| C. | 3-甲基-3-乙基戊烷的一氯取代产物为5种 | |
| D. | 相同条件下乙酸乙酯在水中的溶解度比在乙醇中的溶解度要大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
| 3 | ① | ③ | ④ | ⑨ | ||||
| 4 | ② |
 .
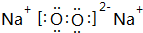
.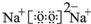 ,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA
,该物质所含化学键类型离子键、共价键,0.1mol X与水反应转移电子数为:0.1NA查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com