
| A. | 平衡不移动 | |
| B. | 平衡向正反应方向移动,Cl2的转化率增大 | |
| C. | 平衡移动,且HClO浓度减小 | |
| D. | 平衡移动,且HClO浓度增大 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的熔、沸点比ⅦA族其他元素氢化物的高 | |
| B. | 水分子高温下也很稳定 | |
| C. | 冰的密度比液态水的密度小 | |
| D. | NH3极易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
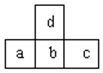
| A. | d的氢化物比b的氢化物稳定 | |
| B. | d与c不能形成化合物 | |
| C. | a、b、c的最高价氧化物对应水化物的酸性强弱的关系是c>b>a | |
| D. | 原子半径的大小顺序是a>b>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>Z>X | |
| B. | 2.24 L(标准状况)M溶于1 L水中,所得溶液的pH约为13 | |
| C. | YZ2能使湿润的淀粉KI试纸变蓝 | |
| D. | Y、W的最髙价氧化物对应的水化物均为强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 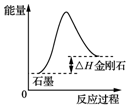 由图可知,从能量角度考虑,金刚石比石墨稳定 | |
| B. | 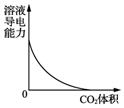 图表示CO2通入饱和Na2CO3溶液中,溶液导电能力的变化 | |
| C. | 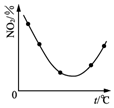 图表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 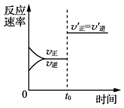 图表示某可逆反应的反应速率随时间的变化,t0时刻改变的条件一定是使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制漂白粉:C12+2OH-═Cl-+ClO-+H2O | |
| B. | 将氯气溶于水制备次氯酸:C12+H2O═2H++Cl-+ClO- | |
| C. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+═Cu2++2Fe2+ | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-242kJ•mol-1 | |
| B. | 若H-H、O═O的键能分别是436 kJ•mol-1和496 kJ•mol-1,则H-O的键能是463 kJ•mol-1 | |
| C. | 据图可知,氢气的燃烧热为242 kJ•mol-1 | |
| D. | 10克氢气在氧气中完全燃烧,放出热量为1210kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com