
| A. | 3mL | B. | 7.5mL | C. | 15mL | D. | 17.5mL |
分析 AlCl3和NaOH反应与NaOH的量的多少有关,当NaOH不足时生成Al(OH)3,当碱过量时,则生成NaAlO2.现AlCl3的物质的量为0.03mol,完全生成Al(OH)3沉淀时,沉淀质量应为2.34g,现沉淀质量为0.78g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2.
解答 解:现AlCl3的物质的量为0.03mol,完全生成Al(OH)3沉淀时,沉淀质量应为2.34g,现沉淀质量为0.78g,说明有两种情况:一为沉淀不完全,只生成Al(OH)3沉淀;另一种情况为沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,n(Al(OH)3)=$\frac{0.78g}{78g/mol}$=0.01mol,
①若碱不足,由Al3++3OH-═Al(OH)3↓可知,
NaOH的物质的量为0.01mol×3=0.03mol,
加入NaOH溶液的体积为$\frac{0.03mol}{4mol/L}$=0.0075L,即7.5mL;
②沉淀部分溶解,既生成Al(OH)3沉淀,又生成NaAlO2,
则由 Al3++3OH-═Al(OH)3↓
0.03mol 0.09mol 0.03mol
Al(OH)3+OH-═AlO2-+2H2O
(0.03-0.01)mol (0.03-0.01)mol
则消耗的碱的物质的量为0.09mol+(0.03-0.01)mol=0.11mol,
加入NaOH溶液的体积为$\frac{0.11mol}{4mol/L}$=0.0275L,即27.5mL;
故选B.
点评 本题考查铝的计算,题目难度中等,本题的解答关键是根据题意确定发生反应的情况,结合反应的有关方程式计算.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:选择题
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数的变化如图所示.已知W的一种核素的质量数为18,中子数为10;X是短周期元素中原子半径最大的;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强.下列说法不正确的是( )| A. | 简单离子半径:W>X>Z | |
| B. | 最简单气态氢化物的稳定性:Y<Z | |
| C. | 化合物XZW中既含离子键又含共价键 | |
| D. | Y的氧化物能与X的最高价氧化物对应的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数K=0.4 | |
| B. | 反应达平衡后,升高温度,平衡正向移动 | |
| C. | 4s内,用A表示的该反应的平均反应速率v(A)=0.01mol/(L•s) | |
| D. | 830℃下反应达平衡时,B的转化率为20% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50 mL 12 mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| B. | 2 L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
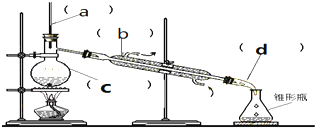
| A. | 仪器C是圆底烧瓶,加热时,液体量不超过容积的$\frac{2}{3}$,不少于容积的$\frac{1}{3}$ | |
| B. | 仪器b是直型冷凝管 | |
| C. | 仪器b中冷却水的进出方向是“下进上出” | |
| D. | 进行蒸馏操作时,温度计的下端不能放在液面以下 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 气体A是NO | |
| B. | X中不能确定的离子是 A13+和C1ˉ | |
| C. | 溶液E和气体F能发生化学反应 | |
| D. | X中肯定存在Fe2+、A13+、NH4+、SO42ˉ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com