
分析 根据纯水中c(OH-)=c(H+),溶液显示中性进行分析;
根据该温度下纯水中氢离子浓度和氢氧根离子浓度,计算出水的离子积,
若温度不变,根据稀硫酸溶液中氢离子浓度和水的离子积计算出溶液中氢氧根离子的浓度,
若温度不变,依据氢氧化钠溶液中氢氧根离子浓度,结合离子积常数计算溶液中氢离子浓度.
解答 解:纯水显示中性,c(OH-)=c(H+)=5.0×10-7mol/L;
此温度下,水的离子积为:Kw=5.0×10-7×5.0×10-7=2.5×10-13,
若温度不变,滴入稀硫酸使c(H+)=5.0×10-3mol/L,硫酸溶液中氢离子浓度c(H+)=5.0×10-3mol/L,c(OH-)=$\frac{2.5×1{0}^{-13}}{5.0×1{0}^{-3}}$mol/L=5.0×10-11 mol/L,
在该温度时,往水中滴入NaOH溶液,溶液中的c(OH-)=5.0×10-6mol/L,则溶液中c(H+)=$\frac{2.5×1{0}^{-13}}{5.0×1{0}^{-6}}$mol/L=5×10-8mol/L,
故答案为:5.0×10-7mol/L;5.0×10-11mol/L;5×10-8mol/L.
点评 本题考查了水的离子积常数的有关计算,注意水的离子积常数只与温度有关,与溶液的酸碱性无关,题目难度中等.


科目:高中化学 来源: 题型:多选题
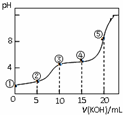 常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )
常温下,用0.05mol•L-1 KOH溶液滴定 10.00mL0.05mol•L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )| A. | 点②溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-) | |
| B. | 点③溶液中:c(K+)=c(HC2O4-)+c(C2O42-)+c(H2C2O4) | |
| C. | 点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.05 mol•L-1 | |
| D. | 点⑤溶液中:c(K+)>c(HC2O4-)>c(C2O42-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ② | C. | ①② | D. | ②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com