
| 同学甲 | 同学乙 | |
| 实验方案 | 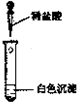 | 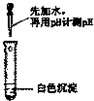 |
| 实验现象 | ||
| 实验结论 | 只有MgCO3 | 只有Mg(OH)2 |
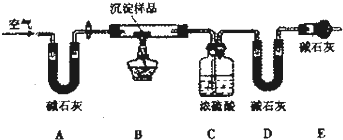
| 实验序号 | 沉淀样品质量 | CO2的物质质量/mol | H2O的物质的量/mol |
| 1 | 3.64 | 0.03 | 0.04 |
| 2 | 7.28 | 0.06 | 0.08 |
| 3 | 10.92 | 0.09 | 0.16 |


科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、a=4 |
| B、Y是四氧化三铁,是氧化产物 |
| C、每有3mol Fe2+参加反应,反应中转移的电子总数为5mol |
| D、将Y均匀分散到水中形成的体系可以发生电泳现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 | B、2 | C、3 | D、4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲、乙、丙、丁、戊五种前四周期元素,其中甲乙丙都为非金属元素,在周期表中的位置关系如图1所示.丁、戊两种元素则位于同一周期同一族,而且戊的原子序数比丁大2.
甲、乙、丙、丁、戊五种前四周期元素,其中甲乙丙都为非金属元素,在周期表中的位置关系如图1所示.丁、戊两种元素则位于同一周期同一族,而且戊的原子序数比丁大2.查看答案和解析>>
科目:高中化学 来源: 题型:
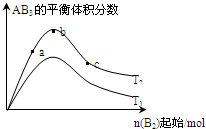
| A、反应速率a>b>c |
| B、若T2>T1,则正反应一定是吸热反应 |
| C、达到平衡时,AB3的物质的量大小为:b>c>a |
| D、达到平衡时A2的转化率大小为:b>a>c |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
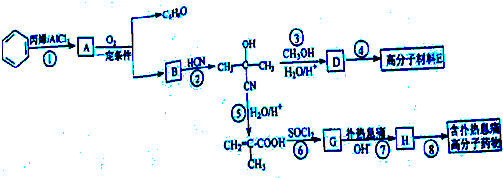
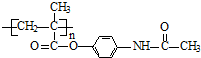 .
.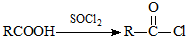

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com