

分析 A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3,据此解答.
解答 解:A是一种常见金属,F是一种红褐色沉淀,由转化关系可知F为Fe(OH)3,A为Fe,Fe与氧气反应生成B为Fe3O4,四氧化三铁与盐酸反应得到氯化亚铁与氯化铁,故Fe与盐酸反应得到X为氢气、C为FeCl2,可推知E为Fe(OH)2、D为FeCl3,G为Fe2O3.
(1)由上述分析可知,A为Fe,C为FeCl2,F为Fe(OH)3,G为Fe2O3,
故答案为:Fe;FeCl2;Fe(OH)3;Fe2O3.
(2)D为FeCl3,含有阳离子为Fe3+,检验Fe3+离子的方法为:取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液红色,证明有Fe3+,
故答案为:取少量D溶液于试管中,滴加几滴KSCN溶液,若溶液红色,证明有Fe3+;
(3)FeCl2易被空气中氧气氧化,保存FeCl2溶液时加固体Fe,防止Fe2+被氧气氧化,
故答案为:防止Fe2+被氧气氧化;
(4)①C→D的反应离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,溶液颜色由浅绿色变为黄色,
故答案为:2Fe2++Cl2=2Fe3++2Cl-;溶液颜色由浅绿色变为黄色.
点评 本题考查无机物推断,涉及Fe元素单质化合物的性质及转化,物质的颜色是推断突破口,再结合转化关系推断各物质,掌握元素化合物的性质是解题的关键.


科目:高中化学 来源: 题型:选择题
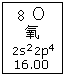
| A. | 氧元素的质量数是16 | |
| B. | 氧元素的相对原子质量是16.00 | |
| C. | 氧原子2p亚层有一个未成对电子 | |
| D. | 氧原子最外层有6个能量相同的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO3- | B. | SO42- | C. | Na+ | D. | H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 二氧化氯消毒液1000mL | |
| 溶质的质量分数 | 80% |
| 密度 | 1.2g/cm3 |
| 强腐蚀性,阴冷,密封储存 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
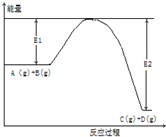 反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.
反应A(g)+B(g)?C(g)+2D(g)的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com