
下列叙述中正确的是
A.常温下,0.01mol·L-1醋酸溶液pH=2
B.95℃纯水的pH<7,说明加热可导致水呈酸性
C.常温下,将pH=3的醋酸溶液稀释至10倍后溶液pH=4
D.常温下,将0.2 mol·L-1的盐酸与等体积水混合后溶液pH=1
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源:2015届山西省大同市高二上学期期末考试化学试卷(解析版) 题型:填空题
(1)有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是 。
(2)向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为_______________。
(3) 现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是_______________
①20 mL 0.01 mol·L-1KCl溶液
②30 mL 0.02 mol·L-1CaCl2溶液
③40 mL 0.03 mol·L-1HCl溶液
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液
(4)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。此电池的负极发生的电极反应式是_______________ ;
(5)某酸H2B在水溶液中有如下变化:H2B H++HB-;HB-
H++HB-;HB- H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题:
①溶液中的H+物质的量取值范围是:
②已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”,“>”,或“=”)
查看答案和解析>>
科目:高中化学 来源:2015届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:填空题
(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH― 四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
a | 0.1 | 0.1 | pH=9 |
b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2015届山东省威海市高二上学期期末考试化学试卷(解析版) 题型:选择题
下列物质的有关事实与电化学腐蚀无关的是
A.轮船水线以下的船壳上镶嵌有一定量的锌块
B.镀锌的铁制品比镀锡的铁制品耐用
C.埋在潮湿疏松土壤里的铁管比干燥致密不透气的土壤里的铁管更易被腐蚀
D.在空气中,金属镁、铝的表面可形成一层氧化膜
查看答案和解析>>
科目:高中化学 来源:2015届天津市红桥区高二上学期期末考试化学试卷(解析版) 题型:选择题
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)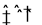 Ca2+(aq)+2OH-(aq) 当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
Ca2+(aq)+2OH-(aq) 当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
A.溶液中Ca2+数目不变 B.溶液中c(Ca2+)增大
C.溶液pH值不变 D.溶液pH值增大
查看答案和解析>>
科目:高中化学 来源:2015届天津市红桥区高二上学期期末考试化学试卷(解析版) 题型:选择题
下列各装置中都盛有0.1 mol·L-1的NaCl溶液,放置相同时间后,锌片的腐蚀速率由快到慢的顺序是
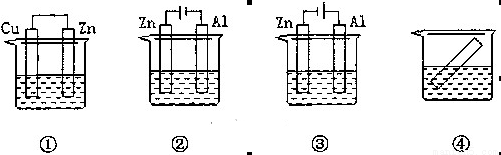
A.③①④② B.①②④③ C.②①④③ D.②①③④
查看答案和解析>>
科目:高中化学 来源:2015届天津市红桥区高二上学期期末考试化学试卷(解析版) 题型:选择题
下列水溶液一定呈碱性的是
A.pH=8的溶液 B.含有OH-离子的溶液
C.NaCl溶液 D.c(OH-)>c(H+)的溶液
查看答案和解析>>
科目:高中化学 来源:2015届天津市和平区高二上学期期末考试化学试卷(解析版) 题型:选择题
把Ca(0H)2放入蒸馏水中,—段时间后达到平衡:
下列说法正确的是( )。
A.向溶液中加CaO,并恢复原温度时,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(0H)2固体质量不变
查看答案和解析>>
科目:高中化学 来源:2015届天津市五区县高二上学期期末考试化学试卷(解析版) 题型:选择题
在密闭容器中的一定量混合气体发生反应: 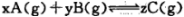 平衡时测得A的浓度为0. 5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时A的浓度变为0. 3m ol/L。下列有关判断正确的是
平衡时测得A的浓度为0. 5mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时A的浓度变为0. 3m ol/L。下列有关判断正确的是
A.B的转化率降低
B.x+y<z
C.平衡向正反应方向移动
D.C的体积分数增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com