
【题目】烃A的质谱图中,质荷比最大的数值为42。碳氢两元素的质量比为6:1,其核磁共振氢谱有三个峰,峰的面积比为1:2:3。A与其他有机物之间的关系如下图所示:

已知:CH2=CH2 ![]() HOCH2CH2OH,回答下列问题:
HOCH2CH2OH,回答下列问题:
(1)F的结构简式为__________________。
(2)有机物C中的官能团名称_______________________。
(3)指出下列转化的化学反应类型:A→B__________ E→G____________。
(4)写出C与新制的氢氧化铜反应的化学方程式___________________________。
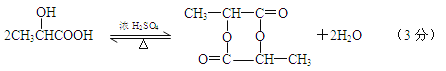
(5)E在一定条件下可以相互反应生成一种六元环有机物,则此反应的化学方程式为__________ 。
(6)与E互为同分异构体,且属于酯类的有机物,除CH3OCOOCH3、CH3CH2OCOOH外还有 __________种(分子中无O—O键)。
【答案】(1)![]() (2分) (2)羰基(或酮基)、醛基 (2分)
(2分) (2)羰基(或酮基)、醛基 (2分)
(3)氧化反应 (1分) 缩聚反应 (1分)
(4)CH3COCHO+2Cu(OH)2+NaOH![]() CH3COCOONa+ Cu2O↓+3H2O (3分)
CH3COCOONa+ Cu2O↓+3H2O (3分)
(5)
(6)5 (3分)
【解析】
试题烃A的质谱图中,质荷比最大的数值为42,即相对分子质量是42。碳氢两元素的质量比为6:1,所以含有碳原子的个数是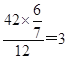 ,氢原子个数是
,氢原子个数是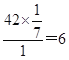 ,因此分子式为C3H6。其核磁共振氢谱有三个峰,峰的面积比为1:2:3,因此A的结构简式为CH3CH=CH2。A中含有碳碳双键,能发生加聚反应生成F,则F的结构简式为
,因此分子式为C3H6。其核磁共振氢谱有三个峰,峰的面积比为1:2:3,因此A的结构简式为CH3CH=CH2。A中含有碳碳双键,能发生加聚反应生成F,则F的结构简式为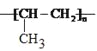 。根据已知3信息可知A被高锰酸钾溶液氧化生成B,则B的结构简式为CH3CHOHCH2OH。B发生催化氧化生成C,则C的结构简式为CH3COCHO。C分子中含有醛基,被氢氧化铜悬浊液氧化并酸化后生成D,则D的结构简式为CH3COCOOH。D与氢气发生加成反应生成E,则E的结构简式为CH3CHOHCOOH。E分子中含有羟基和羧基,发生加聚反应生成G,则G的结构简式为
。根据已知3信息可知A被高锰酸钾溶液氧化生成B,则B的结构简式为CH3CHOHCH2OH。B发生催化氧化生成C,则C的结构简式为CH3COCHO。C分子中含有醛基,被氢氧化铜悬浊液氧化并酸化后生成D,则D的结构简式为CH3COCOOH。D与氢气发生加成反应生成E,则E的结构简式为CH3CHOHCOOH。E分子中含有羟基和羧基,发生加聚反应生成G,则G的结构简式为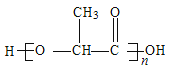 。
。
(1)根据以上分析可知F的结构简式为![]() 。
。
(2)有机物C的结构简式可知,C中的官能团名称羰基(或酮基)、醛基。
(3)根据以上分析可知A→B是氧化反应,E→G是缩聚反应。
(4)C酯含有醛基与新制的氢氧化铜反应的化学方程式为CH3COCHO+2Cu(OH)2+NaOH![]() CH3COCOONa+ Cu2O↓+3H2O。
CH3COCOONa+ Cu2O↓+3H2O。
(5)E在一定条件下可以相互反应生成一种六元环有机物,反应的化学方程式为
 。
。
(6)与E互为同分异构体,且属于酯类的有机物,除CH3OCOOCH3、CH3CH2OCOOH外还有HCOOCH2CH2OH、HCOOCHOHCH3、HCOOCH2OCH3、CH3COOCH2OH、HOCH2COOCH3共计是5种。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】25℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10﹣5 | K1=4.3×10﹣7 K2=5.6×10﹣11 | 3.0×10﹣8 |
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa d.NaHCO3;pH由大到小的顺序是:________________;(填编号)
(2)体积为10mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如图.则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是_________________,稀释后,HX溶液中水电离出来的c(H+)_______醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:_______________________;
(3)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中c(CH3COO﹣)﹣c(Na+)=____________________.(填准确数值).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据表中数据,推测磷元素的原子半径可能是( )
元素 | N | S | O | Si |
原子半径/(10-10m) | 0.75 | 1.02 | 0.73 | 1.11 |
A.0.80×10-10mB.1.10×10-10m
C.1.20×10-10mD.0.70×10-10m
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,
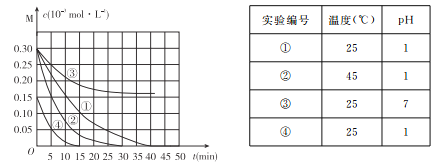
下列说法不正确的是
A. 实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越不利于M的降解
D. 实验④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在某密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
H2(g)+I2(g) ΔH>0,若15s内c(HI)由0.1mol·L-1降到0.07mol·L-1,则下列说法正确的是( )
A. 0~15 s内用I2表示的平均反应速率为v(I2)=0.002 mol·L-1·s-1
B. c(HI)由0.07 mol·L-1降到0.05 mol·L-1所需的反应时间小于10 s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 减小反应体系的体积,化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。而在硫酸的生产中,最关键的一步反应为:2SO2(g)+O2(g)![]() 2SO3(g)。
2SO3(g)。
(1)一定条件下,SO2与O2反应10 min后,若SO2和SO3物质的量浓度分别为0.1 mol/L和0.3 mol/L,则10 min内生成SO3的化学反应速率为___________;SO2的转化率为___________。
(2)下列关于该反应的说法正确的是_________。
A.增加O2的浓度能加快反应速率 B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率 D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中若某一时刻SO2、O2、SO3的浓度分别为0.2 mol/L、0.1 mol/L、0.2 mol/L。当反应达到平衡时,可能存在的数据是______。
A.O2为0.2 mol/L B.SO2为0.25 mol/L
C.SO3为0.4 mol/L D.SO2、SO3均为0.15 mol/L
(4)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体充入2 L的密闭容器中,一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
2C(g)。若经2 s后测得C的浓度为0.6 mol/L,下列几种说法正确的是
①用物质A表示的反应平均速率为0.3 mol/(L·s)
②用物质B表示的反应的平均速率为0.6 mol/(L·s)
③2 s时物质A的转化率为70%
④2 s时物质B的浓度为0.7 mol/L
A. ①③ B. ①④ C. ②③ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com