
【题目】某学习小组辨析以下说法:①粗盐和酸雨都是混合物;②非金属氧化物一定都是酸性氧化物;③冰和干冰既是纯净物又是化合物;④Na2O、Na2O2都是钠的氧化物,都是碱性氧化物;⑤磷酸和醋酸都是多元酸;⑥纯碱和烧碱都是碱。其中正确的是( )
A.②③⑥B.①②④C.①③D.③⑤
科目:高中化学 来源: 题型:
【题目】(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题。
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的![]() 和
和![]() 单质燃烧时均放出大量热,可用作燃料.已知
单质燃烧时均放出大量热,可用作燃料.已知![]() 和
和![]() 为短周期元素,其原子的第一至第四电离能如下表所示:
为短周期元素,其原子的第一至第四电离能如下表所示:
电离能/ |
|
|
|
|
| 932 | 1821 | 15390 | 21771 |
| 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断![]() 的核外电子排布如图所示,该同学所画的电子排布图违背了_________,
的核外电子排布如图所示,该同学所画的电子排布图违背了_________, ![]() 元素位于周期表五个区域中的___ 区。
元素位于周期表五个区域中的___ 区。
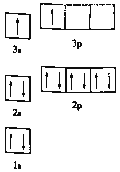
②![]() 分子的中心原子
分子的中心原子![]() 采取_________杂化,
采取_________杂化, ![]() 的空间构型为___ 。
的空间构型为___ 。
(2)![]() 原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
① 与![]() 原子或离子形成配合物的分子或离子应具备的结构特征是____。
原子或离子形成配合物的分子或离子应具备的结构特征是____。
② 六氰合亚铁离子![]() 中不存在____________(填字母)。
中不存在____________(填字母)。
A.共价键 B.非极性键 C.配位键 D. ![]() 键
键
写出一种与![]() 互为等电子体的单质的分子式:________________ 。
互为等电子体的单质的分子式:________________ 。
(3)—种![]() 合金的晶胞结构如图,请据此回答下列问题:
合金的晶胞结构如图,请据此回答下列问题:
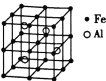
① 该合金的化学式为____________。
② 若晶体的密度为![]()
![]() ,则该晶胞棱长为____________
,则该晶胞棱长为____________![]() (设
(设![]() 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含![]() 和
和![]() 的代数式表示,不必化简)。
的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的实验现象及解释或结论都正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色 | 氧化性:H2O2>Fe3+ |
B | 向5mL1mol/L NaOH溶液中滴加5滴1mol/L MgCl2溶液,然后再滴加足量的1mol/L CuCl2溶液 | 先产生白色沉淀,然后产生蓝色沉淀 | Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 2NO2(g) |
D | 向一定量酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH) | 溶液紫色褪去 | 乙二醇被氧化为乙二酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示判断,下列说法正确的是( )

A. H2A在水中的电离方程式是:H2A===H++HA-、HA-![]() H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性
C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-)
D. 当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[选修3:物质结构与性质]磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性元件。
(1)基态铜原子的电子排布式为_____;高温时氧化铜会转化为氧化亚铜,原因是____________________________________。
(2)元素周期表第3周期中,第一电离能比P小的非金属元素是_______(填元素符号)。
(3)N、P、As同主族,三种元素最简单氢化物沸点由低到高的顺序为____________,原因是____________________________________。
(4)某直链多磷酸钠的阴离子呈如图1所示的无限单链状结构,其中磷氧四面体通过共用顶点的氧原子相连,则P原子的杂化方式为_____,该多磷酸钠的化学式为______。

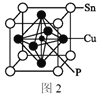
(5)某磷青铜晶胞结构如图2所示。
①则其化学式为______。
②该晶体中距离Sn原子最近的Cu原子有____个。
③若晶体密度为8.82 g·cm-3,最近的Cu原子核间距为______pm(用含NA的代数式表示,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将锌棒和铜棒插入西红柿中,电流表指针发生偏转,如图所示,下列说法正确的是( )

A. 负极反应为Zn-2e-==Zn2+
B. 该装置将化学能转化为电能
C. 电流由锌通过导线流向铜棒
D. 一段时间后,锌棒质量会增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双键完全共轭(单键与双键相间)的单环多烯烃称为轮烯,[8]轮烯(![]() )是其中的一种。下列关于该化合物
)是其中的一种。下列关于该化合物
的说法错误的是( )
A. 与苯乙烯互为同分异构体 B. 能使酸性高锰酸钾溶液褪色
C. 二氯代物有四种 D. 生成 1 mol C8H16 至少需要 4 mol H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com