
分析 ①反应中Mn元素从+7价降低到+2价,化合价降低5价,Cl元素从-1价升高到0价的Cl2,化合价升高2,根据化合价升降守恒得,最小公倍数为10,故Cl2
前系数为5,KMnO4前系数为2,并根据原子守恒配平方程式;为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O;②反应中物质的化合价变化:MnO4-→Mn2+,Mn元素化合价由+7价→+2价,一个MnO4-得5个电子;H2O2→O2,O由-1价变成0价,一个H2O2分子失去2个电子,所以其最小公倍数为10,故MnO4-的计量数为2,双氧水的计量数为5,然后根据原子守恒配平其它元素;
解答 解:①反应中Mn元素从+7价降低到+2价,化合价降低5价,Cl元素从-1价升高到0价的Cl2,化合价升高2,根据化合价升降守恒得,最小公倍数为10,故Cl2
前系数为5,KMnO4前系数为2,并根据原子守恒配平,故方程式为2KMnO4+16HCl═2MnCl2+2KCl+8H2O+5Cl2↑,
故答案为:2;16;2;2;8;5;
②反应中物质的化合价变化:MnO4-→Mn2+,Mn元素化合价由+7价→+2价,一个MnO4-得5个电子;H2O2→O2,O由-1价变成0价,一个H2O2分子失去2个电子,所以其最小公倍数为10,故MnO4-的计量数为2,双氧水的计量数为5,然后根据原子守恒配平其它元素,所以其方程式为:2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O,
故答案为:2;5;6H+;2;5;8.
点评 本题考查了化学方程式的配平,根据氧化还原反应中得失电子相等,也即根据化合价的升降相等来配平.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断钠和镁金属性强弱 | |
| B. | 比较Mg(OH)2与Al(OH)3的碱性强弱,判断镁与铝的金属性强弱 | |
| C. | 往硅酸钠溶液中通入CO2产生白色沉淀,判断碳酸与硅酸的酸性强弱 | |
| D. | 根据HF和HCl的水溶液的酸性强弱判断氟与氯的非金属性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
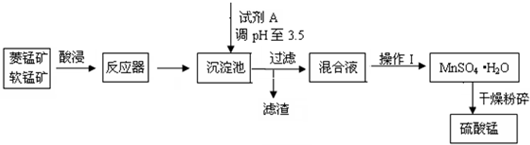
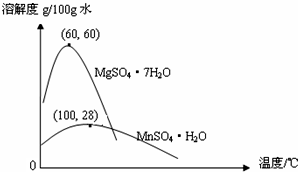
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①③ | C. | ①② | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化钠的电子式: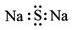 | B. | 中子数为10的氧原子:${\;}_8^{10}O$ | ||
| C. | 硫离子的结构示意图: | D. | HC1O的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 密闭容器中9.6克硫粉与11.2克铁粉混合加热生成硫化亚铁17.6克时放出19.12 kJ热量,则Fe(S)+S(S)=FeS(S)△H=-95.6 kJ•mol-1 | |
| B. | 稀醋酸和0.1mol/L的氢氧化钠溶液反应,H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ/mol | |
| C. | 已知1 mol氢气完全燃烧生成液态水所放出的热量为285.5 kJ,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g)△H=+285.5kJ/mol | |
| D. | 已知2C(s)+O2(g)=2CO(g)△H=-221 kJ/mol,则可知C的燃烧热△H=-110.5 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅含有共价键的物质定是共价化合物 | |
| B. | 单质分子中均存在化学键 | |
| C. | 离子化合物中一定含有离子键,可能含有配位键和共价键 | |
| D. | 由不同种非属元素的原子形成的共价化合物一定只含极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若c=32(a+b),则b=2a | B. | 若c<32(a+b),则a>2b | ||
| C. | 若a<2b,则c=48a | D. | 若a>2b,则32(a+b)>c>96b |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 硫酸溶液/mL | 20.0 | 40.0 | 60.0 | 80.0 |
| 剩余固体/g | 9.36 | 7.12 | 4.88 | 3.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com