
 常温下,将足量的CO2慢慢通入一定体积某浓度的NaOH溶液中,溶液的pH随CO2体积(已换算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法中不正确的是( )
常温下,将足量的CO2慢慢通入一定体积某浓度的NaOH溶液中,溶液的pH随CO2体积(已换算成标准状况)的变化曲线如图所示(不考虑过量的CO2在水中的溶解和反应过程中溶液体积的变化),则下列说法中不正确的是( )| A. | NaOH溶液的物质的量浓度为0.1mol/L | |
| B. | NaOH溶液的体积为2L | |
| C. | 当通入3.36LCO2时溶液中粒子浓度的大小关系满足c(CO32-)>c(HCO3-) | |
| D. | M、N点对应的纵坐标均大于7 |
分析 A.由图可知NaOH溶液pH=13,则氢氧根离子浓度为0.1mol/L,故NaOH溶液的物质的量浓度为0.1mol/L;
B.当通入4.48L二氧化碳时,溶液pH值不再变化,说明反应完全,此时生成NaHCO3,二氧化碳物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,根据C原子、Na离子守恒:n(NaOH)=n(NaHCO3)=n(CO2)=0.2mol,根据V=$\frac{n}{c}$计算氢氧化钠溶液体积;
C.当通入3.36LCO2时,其物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,由于1<n(NaOH):n(CO2)=4:3<2,故反应生成NaHCO3、Na2CO3,令NaHCO3、Na2CO3的物质的量分别为xmol、ymol,根据钠离子守恒、碳原子守恒列方程计算各自物质的量,且盐类水解程度微弱
D.NaOH溶液、碳酸钠溶液、碳酸氢钠溶液均呈碱性.
解答 解:A.由图可知NaOH溶液pH=13,则氢氧根离子浓度为0.1mol/L,故NaOH溶液的物质的量浓度为0.1mol/L,故A正确;
B.当通入4.48L二氧化碳时,溶液pH值不再变化,说明反应完全,此时生成NaHCO3,二氧化碳物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,根据C原子、Na离子守恒:n(NaOH)=n(NaHCO3)=n(CO2)=0.2mol,则氢氧化钠溶液体积为$\frac{0.2mol}{0.1mol/L}$=2L,故B正确;
C.当通入3.36LCO2时,其物质的量为$\frac{3.36L}{22.4L/mol}$=0.15mol,由于1<n(NaOH):n(CO2)=4:3<2,故反应生成NaHCO3、Na2CO3,令NaHCO3、Na2CO3的物质的量分别为xmol、ymol,根据钠离子守恒、碳原子守恒则:$\left\{\begin{array}{l}{x+y=0.15}\\{x+2y=0.2}\end{array}\right.$,解得$\left\{\begin{array}{l}{x=0.1}\\{y=0.5}\end{array}\right.$,由于水解程度微弱,故溶液中粒子浓度的大小关系满足c(HCO3-)>c(CO32-),故C错误;
D.NaOH溶液、碳酸钠溶液、碳酸氢钠溶液均呈碱性,M、N点对应溶液pH均大于7,故D正确,
故选:C.
点评 本题考查学生读图获取信息、运用知识分析解决问题能力,难度中等,是对学生综合能力的考查.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用聚合硫酸铁作为净水剂,该处理过程中仅发生了化学变化 | |
| B. | “血液透析”利用了胶体的性质 | |
| C. | 气象环境报告中的“PM2.5”是对一种新分子的描述 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
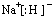 ;D在元素周期表中的位置为第三周期ⅢA族.
;D在元素周期表中的位置为第三周期ⅢA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 制玻璃时会产生CO2 | |
| B. | 生产硅、铝、铜都涉及氧化还原反应 | |
| C. | 制粗硅的反应SiO2+C $\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ | |
| D. | 黄铜矿炼铜产生的SO2可生产硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.铁和稀硝酸反应: |  |
| B.Cl2与FeI2溶液反应后的产物: | 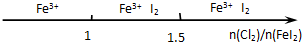 |
| C.向烧碱液中通入SO2后的产物: |  |
| D.向AlCl3溶液中滴加NaOH溶液,铝元素的存在形式: |  |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0mol | B. | 0.67mol | C. | 1mol | D. | 1.33 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com