
ЁОЬтФПЁП25ЁцЁЂ101 kPaЯТЃЌ2gЧтЦјШМЩеЩњГЩвКЬЌЫЎЃЌЗХГі285.8kJШШСПЃЌБэЪОИУЗДгІЕФШШЛЏбЇЗНГЬЪНе§ШЗЕФЪЧ( )
AЃЎ2H2(g) + O2(g) == 2H2OЃЈ1ЃЉ ЁїHЃН ЈD285.8kJЃЏmol
BЃЎ2H2(g) + O2(g) == 2H2OЃЈ1ЃЉ ЁїHЃН +571.6 kJЃЏmol
CЃЎ2H2(g) + O2(g) == 2H2O(g) ЁїHЃН ЈD571.6 kJЃЏmol
DЃЎH2(g) + ![]() O2(g) == H2OЃЈ1ЃЉ ЁїHЃН ЈD285.8kJЃЏmol
O2(g) == H2OЃЈ1ЃЉ ЁїHЃН ЈD285.8kJЃЏmol
 бЇСЗПьГЕЕРПьРжМйЦкЪюМйзївЕаТНЎШЫУёГіАцЩчЯЕСаД№АИ
бЇСЗПьГЕЕРПьРжМйЦкЪюМйзївЕаТНЎШЫУёГіАцЩчЯЕСаД№АИ еуДѓгХбЇаЁбЇФъМЖЯЮНгЕМгыСЗеуНДѓбЇГіАцЩчЯЕСаД№АИ
еуДѓгХбЇаЁбЇФъМЖЯЮНгЕМгыСЗеуНДѓбЇГіАцЩчЯЕСаД№АИ аЁбЇЪюМйзївЕЖЋФЯДѓбЇГіАцЩчЯЕСаД№АИ
аЁбЇЪюМйзївЕЖЋФЯДѓбЇГіАцЩчЯЕСаД№АИ НђЧХНЬг§ЪюМйАЮИпЯЮНгЙуЖЋШЫУёГіАцЩчЯЕСаД№АИ
НђЧХНЬг§ЪюМйАЮИпЯЮНгЙуЖЋШЫУёГіАцЩчЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪжаЪєгкТБДњЬўЕФЪЧ
A. CH3Cl B. NaClO C. CH3CH2OH D. SiF4
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЂёдкФГвЛШнЛ§ЮЊ5 LЕФУмБеШнЦїФкЃЌМгШы 0.2 molЕФCOКЭ0.2 molЕФH2OЃЌдкДпЛЏМСДцдкКЭ800ЁцЕФЬѕМўЯТМгШШЃЌЗЂЩњШчЯТЗДгІЃКCOЃЈgЃЉЃЋH2OЃЈgЃЉ![]() CO2ЃЈgЃЉЃЋH2ЃЈgЃЉЃЛІЄHЃО0ЗДгІжаCO2ЕФХЈЖШЫцЪБМфБфЛЏЧщПіШчЯТЭМЃК
CO2ЃЈgЃЉЃЋH2ЃЈgЃЉЃЛІЄHЃО0ЗДгІжаCO2ЕФХЈЖШЫцЪБМфБфЛЏЧщПіШчЯТЭМЃК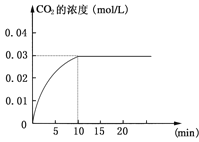
ЃЈ1ЃЉИљОнЩЯЭМЪ§ОнЃЌЗДгІПЊЪМжСДяЕНЦНКтЪБЃЌCOЕФЛЏбЇЗДгІЫйТЪЮЊvЃЈCOЃЉЃН mol/ЃЈLЁЄminЃЉЃЛЗДгІДяЦНКтЪБЃЌcЃЈH2ЃЉЃН________ mol/LЃЌИУЮТЖШЯТЕФЦНКтГЃЪ§K ЁЃ
ЃЈ2ЃЉ ХаЖЯИУЗДгІДяЕНЦНКтЕФвРОнЪЧ________________ЁЃ
Ђй COМѕЩйЕФЛЏбЇЗДгІЫйТЪКЭCO2МѕЩйЕФЛЏбЇЗДгІЫйТЪЯрЕШ
Ђк COЁЂH2OЁЂCO2ЁЂH2ЕФХЈЖШЖМЯрЕШ
Ђл COЁЂH2OЁЂCO2ЁЂH2ЕФХЈЖШЖМВЛдйЗЂЩњБфЛЏ
Ђм е§ЁЂФцЗДгІЫйТЪЖМЮЊСу
ЃЈ3ЃЉШчвЊвЛПЊЪММгШы0.1 molЕФCOЁЂ0.1 molЕФH2OЁЂ0.1 molЕФCO2КЭ0.1 molЕФH2ЃЌдкЯрЭЌЕФЬѕМўЯТЃЌЗДгІДяЦНКтЪБЃЌcЃЈH2OЃЉЃН_____________mol/LЁЃ
ЂђЁЂдкКЌгаI-ЁЂCl-ЕФЛьКЯШмвКжаЃЌж№ЕЮМгШывЛЖЈСПAgNO3ШмвКЃЌЕБAgClПЊЪМГСЕэЪБЃЌШмвКжа![]() ЮЊЃК___________ЃЌвбжЊKspЃЈAgClЃЉ=1.8ЁС10-10ЃЌKspЃЈAgIЃЉ=8.5ЁС10-17ЁЃ
ЮЊЃК___________ЃЌвбжЊKspЃЈAgClЃЉ=1.8ЁС10-10ЃЌKspЃЈAgIЃЉ=8.5ЁС10-17ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПNaHCO2КЭNa2O2АД2ЃК1ЕФИіЪ§жЎБШЛьКЯЃЌдкУмБеШнЦїжаМгШШЪЙжЎГфЗжЗДгІЃЌШЛКѓГУШШХХГіЦјЬхЮяжЪЃЌШнЦїФкВаСєЮяЕФГЩЗжЪЧ
AЃЎжЛга Na2CO3 BЃЎNaHCO3КЭNa2CO3
CЃЎNaOHКЭNa2CO3 DЃЎNa2O2КЭNaHCO3
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУNAБэЪОАЂЗќМгЕТТоГЃЪ§ЕФжЕЁЃЯТСаХаЖЯДэЮѓЕФЪЧ(ЁЁЁЁ)
A. NAИіHЃЋЕФжЪСПЮЊ1 g
B. 2 L 0.5 mol/L Na2SO4ШмвКжаКЌNAИіNaЃЋ
C. 32 g O2жаКЌга2NAИібѕдзг
D. БъзМзДПіЯТЃЌ1 mol H2OжаКЌгаNAИіЗжзг
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЁЂ101kPaЬѕМўЯТЃЌЗДгІ2N2O5 (g)=4NO2 (g)+O2(g) ЁїH=+56.7kJ/molФмздЗЂНјааЕФдвђЃЈ ЃЉ
AЃЎЮќШШЗДгІ BЃЎЗХШШЗДгІ
CЃЎьиМѕаЁЕФЗДгІ DЃЎьидіаЇгІДѓгкШШаЇгІ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЛЏбЇгыЩњЛюЁЂЩчЛсЗЂеЙЯЂЯЂЯрЙиЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧ
A. здРДЫЎжаМгШыТШЦјгыЮлЫЎжаМгШыУїЗЏЕФдРэЯрЭЌ
B. ЦћгЭЁЂИЪгЭЁЂЛЈЩњгЭОљФмЗЂЩњЫЎНтЗДгІКЭбѕЛЏЗДгІ
C. СђЫсЭШмвКПЩгУгкгЮгОГиЕФЯћЖОЪЧРћгУСЫCu2+ФмЪЙЕААзжЪбЮЮі
D. ЯжДњЙЄвЕЩњВњжаЕФЗМЯуЬўРДдДгкЪЏгЭЕФДпЛЏжиећКЭУКЕФИЩСѓ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСагаЙиТШМАЦфЛЏКЯЮяЕФЫЕЗЈДэЮѓЕФЪЧ
AЃЎЙЄвЕЩЯЕчНтШлШкЕФТШЛЏФЦПЩвджЦБИФЦ
BЃЎЙЄвЕЩЯгУCl2КЭЪЏЛвШщЮЊдСЯжЦдьЦЏАзЗл
CЃЎЙЄвЕЩЯЕчНтБЅКЭТШЛЏУОШмвКПЩжЦШЁН№ЪєУО
DЃЎЙЄвЕЩЯГЃгУH2дкCl2жаШМЩеЩњГЩЕФТШЛЏЧтШмгкЫЎРДжЦШЁбЮЫс
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉЂйЯжга11g CO2КЭ5.5g N2OЕФЮяжЪЕФСПжЎБШЮЊ ЃЌФІЖћжЪСПжЎБШЮЊ ЃЌбѕдзгЕФИіЪ§жЎБШЮЊ ЃЎ
ЃЈ2ЃЉжЪСПЯрЕШЕФСНжжЮяжЪSO2КЭSO3ЃЌСНжжЮяжЪжаСђдЊЫижЪСПжЎБШЮЊ ___________ ЃЌЗжзгЮяжЪЕФСПжЎБШЮЊ ___________ ЃЌЫљКЌбѕдзгИіЪ§жЎБШЮЊ ___________ ЃЎ
ЃЈ3ЃЉ0.2L 0.5mol/L Al2ЃЈSO4ЃЉ3ШмвККЭ0.5L 0.5mol/L Al2ЃЈSO4ЃЉ3ШмвКЫљКЌSO42-РызгХЈЖШжЎБШЮЊ ___________ ЃЌSO42-РызгЪ§ФПжЎБШЮЊ ___________ ЃЎ
ЃЈ4ЃЉ20.6g NaRКЌгаNa+0.2molЃЌдђNaRЕФФІЖћжЪСПЮЊ ___________ ЃЌдђКЌR 8.0gЕФNaRЕФЮяжЪЕФСПЮЊ ___________ molЃЎ
ЃЈ5ЃЉЪЕбщЪвгУЖўбѕЛЏУЬгыХЈбЮЫсЗДгІжЦШЁТШЦјЃЌЗДгІЗНГЬЪНШчЯТЃК
MnO2+4HClЃЈХЈЃЉ![]() MnCl2+2H2O+Cl2Ёќ
MnCl2+2H2O+Cl2Ёќ
Шє0.1molMnO2гызуСПЕФХЈбЮЫсГфЗжЗДгІЃЌдђга __________ mol HClБЛбѕЛЏЃЌзЊвЦЕчзгЕФЮяжЪЕФСПЮЊ __________ molЃЌВњЩњЕФCl2дкБъзМзДПіЯТЕФЬхЛ§ЮЊ __________ LЃЎ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com