
| A、已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.3 kJ?mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量 |
| B、已知2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ?mol--1,则氢气的燃烧热为241.8 kJ?mol-1 |
| C、已知2C(s)+2O2(g)═2CO2(g)△H=a 2C(s)+O2(g)═2CO(g)△H=b,则a>b |
| D、已知P (白磷,s)=P (红磷,s)△H<0,则白磷比红磷稳定 |


科目:高中化学 来源: 题型:
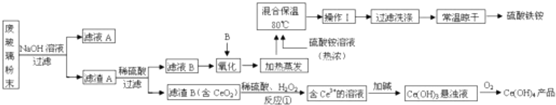
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它属于有机高分子 |
| B、它能产生“白色污染” |
| C、它形成的单体是乙烯 |
| D、对聚乙烯塑料垃圾应进行深埋或倾倒入海 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ② | |||
| ⑦ | ⑧ |
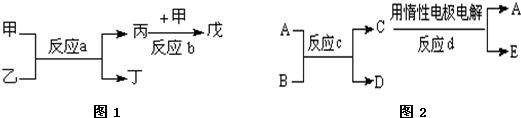
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | 在X形成的某些化合物中,X原子最外层达到2电子稳定结构 |
| Q | 与Y同周期且第一电离能比Y大 |
| Y | Y的一种单质是绿色植物光合作用的产物 |
| Z | Z是一种亲氧元素,其单质是一种制太阳能电池的常用材料 |
| W | 属于副族元素,且W的基态原子核外无弧原子 |
| X-Q | 391 | Y=Y | 498 | Q≡Q | 946 | X-Y | 463 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自来水 |
| B、0.5mol?L-1醋酸 |
| C、0.5mol?L-1硝酸 |
| D、0.5mol?L-1NaCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com