


科目:高中化学 来源: 题型:
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法:
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。确定CaCl2溶液是否过量的方法是 洗涤沉淀并判断沉淀是否洗净的操作是_______________________________________。
(2)乙组:气体分析法:
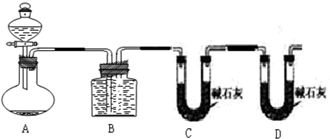
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是____________,选用该溶液后实验结果还是不准确,原因是_________________。
(3)请你设计一个与甲、乙两组操作不同的实验方案,测定混合
物中Na2CO3的含量。
方法: ;
试剂:_________________________________________________________________。
用到的玻璃仪器:_______________________________________________(至少2件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
(16分)
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法:
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。确定CaCl2溶液是否过量的方法是 洗涤沉淀并判断沉淀是否洗净的操作是_____________________________。
(2)乙组:气体分析法:
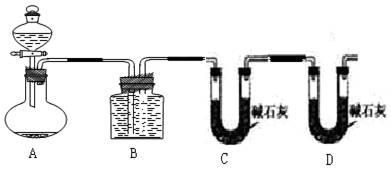
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是____________,选用该溶液后实验结果还是不准确,原因是_________________。
(3)请你设计一个与甲、乙两组操作不同的实验方案,
测定混合物中Na2CO3的含量。
方法: ;
试剂:_________________________________________________________________。
用到的玻璃仪器:_____________________________________________(至少2件)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省南昌市高三9月月考化学试卷(解析版) 题型:实验题
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。
确定CaCl2溶液是否过量的方法是____________________________________,
判断沉淀是否洗净的操作是____________________________________________。
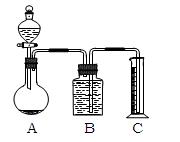
(2)乙组:气体分析法
用如图装置进行实验,为了减少误差,分液漏斗中应该用____________溶液,B中应该用_____________________溶液,选用该溶液后实验结果还是不准,请问是_____________,(填“偏高”、“偏低”或“无影响”)原因是______________________________________。
(3)请你设计一个与甲、乙两组操作不同的实验方案,测定混合物中Na2CO3的含量。
方案:__________________________________。
用到的主要试剂:_____________________________________。
用到的玻璃仪器:_____________________________________(至少2件)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年湖北省天门市高三模拟考试(一)(理综)化学部分 题型:实验题
(16分)
甲、乙两个实验小组分别进行“测定Na2CO3和NaCl混合物中Na2CO3含量”的实验。
(1)甲组:沉淀分析法:
把一定量的混合物溶解后加入过量CaCl2,然后将所得沉淀过滤、洗涤、烘干、称量。确定CaCl2溶液是否过量的方法是 洗涤沉淀并判断沉淀是否洗净的操作是_____________________________。
(2)乙组:气体分析法:
把一定量的混合物与足量盐酸反应后,用如图装置测定产生的CO2气体的体积,为减小CO2的溶解,B中溶液应是____________,选用该溶液后实验结果还是不准确,原因是_________________。
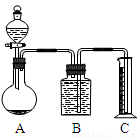
(3)请你设计一个与甲、乙两组操作不同的实验方案,
测定混合物中Na2CO3的含量。
方法: ;
试剂:_________________________________________________________________。
用到的玻璃仪器:_____________________________________________(至少2件)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com