
ij�¶�(t��)ʱ�����0.01 mol/L��NaOH��Һ��pH��11������¶���ˮ��Kw��________���ڴ��¶��£���pH��a��NaOH��ҺVaL��pH��b��H2SO4��ҺVbL��ϣ�
(1)�����û��ҺΪ���ԣ���a��12��b��2����Va��Vb��________��
(2)�����û��ҺΪ���ԣ���a��b��12����Va��Vb��________��
(3)�����û��Һ��pH��10����a��12��b��2����Va��Vb��________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ���� ��� |
�¶� /�� |
��ʼ��/mol | ƽ����/mol | �ﵽƽ���ʱ��/min | ��ƽ��ʱ��ϵ�����ı仯/kJ | ||
| CO | H2O | CO2 | H2 | ||||
| �� | 650 | 1 | 2 | 0.4 | 0.4 | 5 | 16.4kJ |
| �� | 650 | 2 | 4 | t1 | Q1 kJ | ||
| �� | 900 | 2 | 4 | 1.6 | 1.6 | t2 | Q2 kJ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
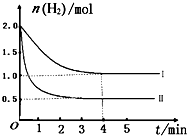 ��2013?������ģ����ҵ�ϡ��̶���������CO2����Ч�ؼ��ᡰ����ЧӦ����
��2013?������ģ����ҵ�ϡ��̶���������CO2����Ч�ؼ��ᡰ����ЧӦ����| ���ʵĻ�ѧʽ | CH3COOH | H2CO3 | |
| ����ƽ�ⳣ�� | K=1.8��10-5 | K1=4.3��10-7 | K2=5.6��10-11 |
| c(CH3COO-) |
| c(CH3COOH) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| ������� | ��ʼʱ���������ʵ���/mol | �ﵽƽ���ʱ��/min | ��ƽ��ʱ��ϵ�����ı仯/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| �� | 1 | 4 | 0 | 0 | t1 | �ų�������32.8 kJ | |
| �� | 2 | 8 | 0 | 0 | t2 | �ų�������Q | |
| 4 |
| Vt1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com