

| 沸点/℃ | 密度(g.cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.5 | 0.8107 | 微溶 |
分析 实验步骤如下:
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中.
②在A中加入4.0g正丁醇和几粒沸石,加热.当有蒸汽出现时,开始滴加B中溶液.滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分.
③将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g.
(1)B仪器的名称是分液漏斗,D仪器的名称直形冷凝管;
(2)加入沸石的作用是防止暴沸;
(3)由表中数据可知,正丁醛密度小于水的密度,据此判断;
(4)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(5)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式C4H10O~C4H8O列方程计算.
解答 解:(1)B仪器的名称是分液漏斗,D仪器的名称直形冷凝管,故答案为:分液漏斗;直形冷凝管;
(2)液体混合液加热为防止加热发生暴沸需要加入沸石,沸石的作用是防止暴沸,故答案为:防止暴沸;
(3)正丁醛密度为0.8017 g•cm-3,小于水的密度,故分层水层在下方,故答案为:下;
(4)根据题目所给反应物和产物的沸点数据可知,反应温度保持在90~95℃,既可保证正丁醛及时蒸出,又可尽量避免其被进一步氧化,
故答案为:保证正丁醛及时蒸出,又可尽量避免其被进一步氧化;
(5)设正丁醛的产率为x,则正丁醇的利用率为x,根据关系式,
C4H10O~C4H8O
74 72
4xg 2g
解得:x=$\frac{74×2}{72×4}$×100%=51%,
故答案为:51.
点评 本题考查有机化学实验、反应原理、基本操作、化学计算等,难度不大,注意计算中正丁醇的转化率等于正丁醛的产率,注意对基础知识的理解掌握.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: +H2O+H2SO4$\stackrel{100-130℃}{→}$
+H2O+H2SO4$\stackrel{100-130℃}{→}$ +NH4HSO4
+NH4HSO4 +Cu(OH)2→
+Cu(OH)2→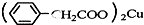 +H2O
+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O与18O互为同位素,H218O与D218O互为同素异形体,甲醇、乙二醇与丙三醇互为同系物 | |
| B. | 在SiO2晶体中,一个Si原子和2个O原子形成两个共价键 | |
| C. | 1L0.5mol/L 稀硫酸与1L 1mol/L 氢氧化钠溶液反应放出57.3kJ的热:H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(1);△H=-114.6 kJ/mol | |
| D. | 碳酸钠水溶液显碱性的原因:CO32-+2H2O?H2CO3+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH值减小 | B. | c(H+)和c(OH-)的乘积增大 | ||
| C. | 酸性减弱 | D. | OH-离子浓度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除③外 | B. | ④⑤⑥⑦⑧ | C. | ⑤⑦⑧ | D. | ①⑤⑦⑧ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com