
【题目】2.3g乙醇和一定量的氧气混合点燃,恰好完全燃烧,放出热量为68.35kJ。
(1)该反应的热化学方程式为___。
(2)已知:
化学键 | Si-Cl | H-H | H-Cl | Si-Si |
键能/kJ·mol-1 | 360 | 436 | 431 | 176 |
且硅晶体中每个硅原子和其他4个硅原子形成4个共价键。
工业上所用的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热为___kJ·mol-1。
Si(s)+4HCl(g),该反应的反应热为___kJ·mol-1。
(3)已知水的比热容为4.2×10-3kJ·g-1·℃-1。8g硫黄在O2中完全燃烧生成气态SO2,放出的热量能使500g H2O的温度由18℃升至58℃,则硫黄燃烧热的热化学方程式为___。
【答案】CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH= -1367kJ·mol-1 +236 S(s)+O2(g)=SO2(g) ΔH= -336kJ·mol-1
【解析】
(1)题中乙醇的物质的量为0.05mol,需要将乙醇的物质的量化为1mol,并计算出相应的热量,再写出对应的热化学方程式;
(2)反应的焓变=反应物的总键能-生成物的总键能;
(3)题中硫磺的物质的量为0.25mol,需要将硫磺的物质的量转化为1mol,并计算出相应的热量,再写出对应的热化学方程式;
(1)n(CH3CH2OH)=![]() =0.05mol,则1mol乙醇完全燃烧放热1367kJ,故该反应的热化学方程式为CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH= -1367kJ·mol-1;
=0.05mol,则1mol乙醇完全燃烧放热1367kJ,故该反应的热化学方程式为CH3CH2OH(l)+3O2(g)=2CO2(g)+3H2O(l) ΔH= -1367kJ·mol-1;
(2)1mol Si晶体中含有2mol Si-Si键,则该反应的反应热=反应物的键能-生成物的键能=(4×360+2×436-4×431-2×176)kJ·mol-1=236kJ·mol-1;
(3)Q=cm△t=4.2×10-3kJ·g-1·℃-1×500g×40℃=84kJ,n(S)=![]() =0.25mol,所以1mol硫磺完全燃烧,放出热量336kJ,则硫黄燃烧热的热化学方程式为S(s)+O2(g)=SO2(g) ΔH= -336kJ·mol-1。
=0.25mol,所以1mol硫磺完全燃烧,放出热量336kJ,则硫黄燃烧热的热化学方程式为S(s)+O2(g)=SO2(g) ΔH= -336kJ·mol-1。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的离子方程式为___。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该反应的化学方程式___。配制FeCl3溶液和FeCl2溶液都应保持___(填“酸性”“碱性”或“中性”),原因是___。配制FeCl2溶液时还应加入少量铁屑,原因是___。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+I3- ②I3-+2S2O32-=3I-+S2O62-
反应①中的还原产物为___。现取10.00mL含Cu2+的溶液,加入足量KI充分反应后,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液12.50mL,此溶液中Cu2+的浓度为___mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
①由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深
②黄绿色的氯水光照后颜色变浅
③使用催化剂可加快SO2转化为SO3的速率
④在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
A.②③B.②④C.①③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯(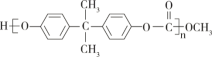 )的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(
)的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(![]() )与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
)与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
A. Y的分子结构中有2个酚羟基 B. Y的分子式为C15H18O2
C. X的核磁共振氢谱有1个吸收峰 D. X、Y生成聚碳酸酯发生的是缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年为国际化学元素周期表年。鉝(Lv)是116号主族元素。下列说法不正确的是( )
A.Lv位于第七周期第ⅥA族B.Lv在同主族元素中金属性最弱
C.Lv的同位素原子具有相同的电子数D.中子数为177的Lv核素符号为![]() Lv
Lv
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C,具有明显的抗衰老作用,但易被空气氧化.某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如下: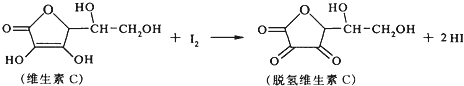
下列说法正确的是( )
A. 上述反应为取代反应
B. 维生素C不可溶于水,可溶于有机溶剂
C. 维生素C在酸性条件下水解只得到1种产物
D. 脱氢维生素C的分子式为C6H8O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的反应热:
(1)CH3COOH(l) + 2O2(g) = 2CO2(g) + 2H2O(l) △ H1 = 870.3 kJ · mol1
(2)C(s) + O2(g) = CO2(g) △ H2 = 393.5 kJ · mol1
(3)H2(g) + O2(g) = H2O(l) △ H3 = 285.8 kJ · mol1
则下列反应的反应热为( )2C(s) + 2H2(g) + O2(g) = CH3COOH(l)
A.△ H =+ 488.3 kJ · mol1B.△ H = 244.15 kJ · mol1
C.△ H = 977.6 kJ · mol1D.△ H = 488.3 kJ · mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质,以C4H10为燃料,该电池工作原理如图。下列说法正确的是( )

A.a为C4H10,b为CO2
B.在熔融电解质中,CO32-向正极移动
C.此电池在常温时也能工作
D.通入丁烷的一极是负极,电极反应式为C4H10-26e-+13CO32-=17CO2↑+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确的是( )

A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. 20℃时,H2C2O4的二级电离平衡常数Ka2=1×10-4.2
C. Q点对应溶液中lgc(H+)<lgc(OH-)
D. 0.100mol·L-1的NaHC2O4溶液中:c(OH-)=c(H+)-2c(C2O42-)+c(H2C2O4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com