

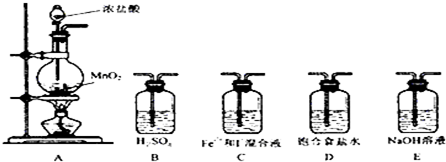
分析 (1)配制氯化铁溶液时,应加相应的酸抑制铁离子水解,在烧杯中稀释配制溶液;
(2)a、硝酸与亚硫酸钠反应生成硫酸钠、NO或NO2;
b、较强酸制较弱酸,Na2SO3固体与浓硫酸反应生成二氧化硫;
c、较强酸制较弱酸,CaSO3固体与稀硫酸反应生成二氧化硫,但硫酸钙微溶;
d、碳与热浓H2SO4生成二氧化硫同时还生成二氧化碳;
(3)二氧化硫能溶于水生成亚硫酸,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气;
(4)二氧化硫具有还原性,氯化铁具有氧化性,二者发生氧化还原反应生成氯化亚铁和硫酸根离子;
(5)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应,根据还原剂的还原性大于还原产物的还原性分析;
(6)根据SO2的化学性质和尾气的处理方法解答;
(7)二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色.
解答 解:(1)配制氯化铁溶液时,需先把氯化铁晶体溶解在浓盐酸中,再加水稀释,这样操作的目的是抑制铁离子水解;
故答案为:浓盐酸;
(2)a、硝酸具有强氧化性,硝酸与亚硫酸钠反应生成硫酸钠、NO或NO2,故A错误;
b、浓硫酸属于强酸,Na2SO3固体与浓硫酸反应生成二氧化硫,故B正确;
c、CaSO3固体与稀硫酸反应生成二氧化硫,但硫酸钙微溶,覆盖在CaSO3固体表面,阻止反应的进行,故C错误;
d、碳与热浓H2SO4反应生成二氧化硫、二氧化碳和水,生产的二氧化硫混有二氧化碳等杂质,故D错误;
故答案为:b;
(3)二氧化硫能溶于水生成亚硫酸,二氧化硫和亚硫酸钠、碳酸氢钠反应,为防止二氧化硫溶解,应该用亚硫酸氢钠溶液洗气,故选c;
(4)二氧化硫具有还原性,氯化铁具有氧化性,二者发生氧化还原反应生成氯化亚铁和硫酸根离子,离子方程式为:2Fe3++SO2+2H2O=SO42+2Fe2++4H+,
故答案为:2Fe3++SO2+2H2O=SO42+2Fe2++4H+;
(5)二氧化硫能使含有碘的淀粉溶液褪色,说明发生了氧化还原反应:I2+SO2+2H2O=2HI+H2SO4,碘是氧化剂,二氧化硫是还原剂,还原剂的还原性大于还原产物的还原性;
故答案为:装置D中溶液蓝色褪去;
(6)在SO2与碘反应后,会有一部分SO2没有参与反应,直接排放带空气中会造成环境污染,因此要用氢氧化钠溶液吸收SO2来防止污染空气;
故答案为:吸收未反应的SO2,防止空气污染;
(7)二氧化硫有还原性,高锰酸钾有强氧化性,二氧化硫能与高锰酸钾发生氧化还原反应使高锰酸钾溶液褪色,Fe2+也使高锰酸钾溶液褪色,
故答案为:方案①;过量的SO2也能使KMnO4溶液褪色.
点评 本题考查实验方案设计,侧重考查气体的制取、气体的性质等知识点,明确物质的性质是解本题关键,知道每个装置中发生的反应,注意浓硫酸不能氧化二氧化硫,为易错点.


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20% | B. | 30% | C. | 45% | D. | 55% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ | 其它 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象与结论 |
| 取少量反应的溶液置于A、B两支试管中; 向A试管中滴加KSCN; 向B试管中滴加淀粉: | ①若A变红色, B不变色则假设1成立 ②若A不变色, B变蓝色则假设2成立 ③若A变红色, B变蓝色则假设3成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
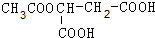 +H2O.
+H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ/mol,则含40.0gNaOH的稀溶液与醋酸完全中和,放出57.3kJ的热量 | |
| C. | CO(g)的燃烧热是283.0kJ/mol,则表示CO(g)的燃烧热的热方程式为2CO(g)+O2(g)=2CO2(g)△H=-283.0kJ/mol | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H=akJ/mol,2C(s)+O2(g)=2CO(g)△H=bkJ/mol,则b>a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、X、Y是原子序数依次增大的前20号元素,其中A~D的原子序数 是连号的,A的基态原子有3个不同的能级,各能级中的电子数相等;X和Y位于同一主族,
已知A、B、C、D、X、Y是原子序数依次增大的前20号元素,其中A~D的原子序数 是连号的,A的基态原子有3个不同的能级,各能级中的电子数相等;X和Y位于同一主族,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com