
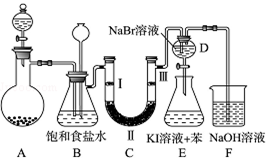
分析 (1)依据仪器的形状说出其名称;
(2)关闭分液漏斗活塞,形成一个密闭系统进行检验;
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(4)氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,据此判断解答;
(5)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(6)依据氧化还原反应中氧化剂氧化性大于氧化产物氧化性解答.
解答 解:(1)依据仪器的形状可知,装置A中两个玻璃仪器名称分别是分液漏斗和蒸馏烧瓶;
故答案为:分液漏斗;蒸馏烧瓶;
(2)检查A装置的气密性方法:关闭分液漏斗活塞,用酒精灯微热圆底烧瓶,若发现B中有气泡冒出,则说明A气密性良好;
故答案为:关闭分液漏斗活塞,用酒精灯微热圆底烧瓶,若发现B中有气泡冒出,则说明A气密性良好;
(3)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,化学方程式:Cl2+2NaOH=NaCl+NaCl+H2O,
故答案为:Cl2+2NaOH=NaCl+NaCl+H2O;
(4)氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以可以用盛有饱和食盐水的B除去氯气中混有的氯化氢;
故答案为:除去氯气中氯化氢气体;
(5)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中ab的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性;c中II为固体干燥剂,不能为浓硫酸,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,
故答案为:无水氯化钙;
(6)当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙色,则说明氯气与溴溴化钠反应生成溴单质,依据氧化还原反应中氧化剂氧化性大于氧化产物氧化性可知氯气的氧化性大于溴的氧化性;
故答案为:大于.
点评 本题考查性质实验方案的制备,为高频考点,把握氯气的性质、制法、装置的作用及氧化还原反应原理为解答的关键,注意同主族元素性质的递变规律,题目难度中等.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:选择题
| A. | H2SO4→HCl→K2S→NaOH→CO2 | B. | NaCl→Na2SO4→Na2S→NH3•H2O→HCl | ||
| C. | Na2S→Na2SO4→NaCl→NaOH→HCl | D. | NaCl→Na2SO4→H2S→NaOH→CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
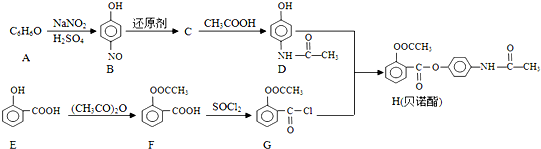
 ;E中含氧官能团的名称为羟基、羧基.
;E中含氧官能团的名称为羟基、羧基. .
.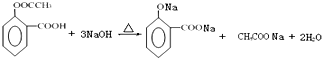 .
.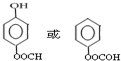 .
.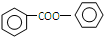 的合成路线流程图(无机试剂可任选):
的合成路线流程图(无机试剂可任选):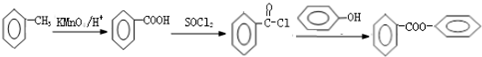 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
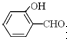 形成分子内氢键,而
形成分子内氢键,而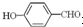 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的气态N4分子,其分子结构如右图所示.已知断裂1mol N-N吸收167kJ热量,生成1mol N≡N放出942kJ热量,根据以上信息和数据,判断下列说法正确的是( )| A. | N4属于一种新型的化合物 | |
| B. | N4是N2的同素异形体 | |
| C. | N4分子中N-N键角为109°28′ | |
| D. | 1 mol N4转变成N2将吸收882 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知Zn+CuSO4═Cu+ZnSO4,设计原电池:构造如图1所示,试问ZnSO4溶液放在甲(填“甲”或“乙”)烧杯,盐桥中的离子向两端烧杯移动,构成闭合回路,K+移向乙(填“甲”或“乙”)烧杯.
已知Zn+CuSO4═Cu+ZnSO4,设计原电池:构造如图1所示,试问ZnSO4溶液放在甲(填“甲”或“乙”)烧杯,盐桥中的离子向两端烧杯移动,构成闭合回路,K+移向乙(填“甲”或“乙”)烧杯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱式碳酸铜、烧碱均属碱 | |
| B. | CO、SO2均属酸性氧化物 | |
| C. | 凡能电离出H+的化合物均属酸 | |
| D. | 盐类物质一定含有金属离子或铵根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
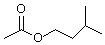 )是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:
)是组成蜜蜂信息素的成分之一,具有香蕉的香味,实验室制备乙酸异戊酯的反应装置示意图(有关的加热和夹持仪器略去)和有关数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸 | 60 | 1.0492 | 118 | 溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A.NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O
B.足量的溴化亚铁和少量的氯气反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
C.钢铁发生吸氧腐蚀的正极反应式:O2+4e-+2H2O=4OH-
D.用铁作电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com